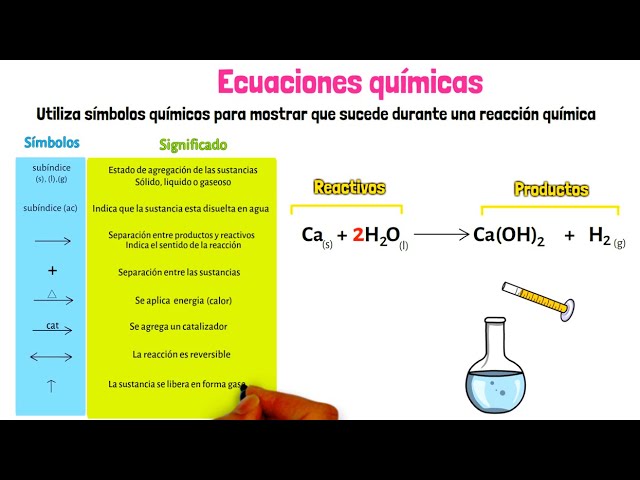
Cuando nos adentramos en el fascinante mundo de la química, es inevitable encontrarnos con ecuaciones químicas. Estas representaciones son fundamentales para entender las reacciones que ocurren en la naturaleza. Pero, ¿qué son exactamente los signos auxiliares en una ecuación química y por qué son tan importantes? En este artículo, exploraremos a fondo el papel que juegan estos signos en la representación de reacciones químicas. Desde los signos de estado hasta los coeficientes estequiométricos, desglosaremos cada elemento y su función específica. Al final de esta guía, no solo tendrás una comprensión clara de los signos auxiliares, sino que también estarás mejor preparado para interpretar y escribir ecuaciones químicas con confianza.
¿Qué son los signos auxiliares en una ecuación química?
Los signos auxiliares son elementos que se utilizan en las ecuaciones químicas para proporcionar información adicional sobre las sustancias involucradas en una reacción. Esta información es crucial para entender cómo y en qué condiciones ocurren las reacciones químicas. Los signos auxiliares incluyen:
- Signos de estado
- Coeficientes estequiométricos
- Signos de reacción
Signos de estado
Los signos de estado indican el estado físico de una sustancia en una reacción química. Estos signos son:
- (s): sólido
- (l): líquido
- (g): gas
- (aq): solución acuosa
Por ejemplo, en la ecuación H2(g) + O2(g) → 2H2O(l), los signos indican que el hidrógeno y el oxígeno son gases, mientras que el agua es un líquido. Esto es esencial porque el estado de las sustancias puede afectar la velocidad y el tipo de reacción que ocurre.
Coeficientes estequiométricos
Los coeficientes estequiométricos son números que aparecen delante de las fórmulas químicas en una ecuación. Estos números indican la proporción en la que las sustancias reaccionan y se producen. Por ejemplo, en la ecuación 2H2(g) + O2(g) → 2H2O(l), el coeficiente ‘2’ frente al H2 indica que se requieren dos moléculas de hidrógeno para reaccionar con una molécula de oxígeno, produciendo dos moléculas de agua.
La correcta interpretación de estos coeficientes es vital para realizar cálculos de cantidad de reactivos y productos, lo que se conoce como estequiometría. Esto se aplica en diversas áreas, desde la industria química hasta la biología y la medicina.
Importancia de los signos auxiliares en la química
Los signos auxiliares son más que meros adornos en una ecuación química; son elementos clave que permiten a los científicos y estudiantes comprender la naturaleza de las reacciones. Sin ellos, las ecuaciones químicas serían incompletas y potencialmente confusas. Aquí exploramos su importancia en diferentes contextos:
Facilitan la comprensión de reacciones
Los signos auxiliares ayudan a clarificar cómo se comportan las sustancias durante una reacción. Por ejemplo, el uso de signos de estado permite anticipar si se generará un gas o un precipitado, lo que es esencial en experimentos de laboratorio. Sin esta información, podríamos malinterpretar los resultados de una reacción.
Permiten realizar cálculos precisos
Los coeficientes estequiométricos son fundamentales para calcular la cantidad de reactivos necesarios y el rendimiento de los productos. Por ejemplo, si se desea sintetizar una cantidad específica de agua, se puede utilizar la relación de los coeficientes para determinar cuántas moléculas de hidrógeno y oxígeno se requieren. Esto es especialmente importante en procesos industriales donde la eficiencia y la economía son cruciales.
Proveen información sobre condiciones de reacción
Los signos de estado también indican las condiciones bajo las cuales se llevan a cabo las reacciones. Esto es vital para los químicos, ya que les permite ajustar las condiciones experimentales para optimizar la reacción. Por ejemplo, si una reacción requiere un reactivo en estado gaseoso, el control de la temperatura y la presión se vuelve esencial para asegurar que la reacción se lleve a cabo de manera efectiva.
Ejemplos de ecuaciones químicas con signos auxiliares
Veamos algunos ejemplos prácticos que ilustran cómo se utilizan los signos auxiliares en las ecuaciones químicas:
Ejemplo 1: Combustión del metano
La combustión del metano se puede representar como:
CH4(g) + 2O2(g) → CO2(g) + 2H2O(g)
En esta ecuación, los signos de estado indican que el metano y el oxígeno son gases, mientras que el dióxido de carbono también es gas, pero el agua se encuentra en estado gaseoso debido a la alta temperatura de la reacción. Los coeficientes muestran que se necesita dos moléculas de oxígeno para quemar una de metano, generando dióxido de carbono y vapor de agua.
Ejemplo 2: Formación de cloruro de sodio
La reacción entre el sodio y el cloro se puede escribir como:
2Na(s) + Cl2(g) → 2NaCl(s)
En este caso, el sodio es un sólido y el cloro es un gas. La reacción produce cloruro de sodio, que también es un sólido. Este ejemplo destaca cómo los signos de estado son cruciales para entender la naturaleza de los productos de la reacción.
Errores comunes al usar signos auxiliares
Los signos auxiliares son herramientas poderosas, pero su mal uso puede llevar a errores en la interpretación de las ecuaciones químicas. A continuación, se presentan algunos de los errores más comunes:
Omitir los signos de estado
Un error frecuente es no incluir los signos de estado en las ecuaciones. Esto puede resultar en una comprensión incompleta de la reacción. Por ejemplo, si se omite el signo de estado de un reactivo gaseoso, se puede subestimar la importancia de las condiciones de presión y temperatura en la reacción.
Confundir los coeficientes
Otro error común es confundir los coeficientes estequiométricos. Esto puede llevar a cálculos incorrectos sobre la cantidad de reactivos necesarios. Por ejemplo, si se piensa erróneamente que se necesitan tres moléculas de un reactivo cuando en realidad se requieren dos, esto afectará todo el cálculo de la reacción.
Ignorar las condiciones de reacción
Finalmente, ignorar las condiciones específicas de la reacción puede ser un error crítico. Por ejemplo, si se asume que una reacción ocurre a temperatura ambiente cuando en realidad requiere calor, los resultados no serán los esperados.
Prácticas recomendadas para utilizar signos auxiliares
Para evitar errores y maximizar la comprensión de las ecuaciones químicas, aquí hay algunas prácticas recomendadas:
- Siempre incluye los signos de estado: Esto te ayudará a tener una imagen completa de la reacción.
- Verifica los coeficientes: Asegúrate de que los coeficientes reflejen la proporción correcta de reactivos y productos.
- Consulta la literatura: Siempre es útil revisar ejemplos en libros de texto o recursos en línea para ver cómo se aplican los signos auxiliares en diferentes contextos.
- Practica la escritura de ecuaciones: Cuanto más practiques, más cómodo te sentirás al usar los signos auxiliares correctamente.
¿Por qué son importantes los signos de estado en las ecuaciones químicas?
Los signos de estado son importantes porque indican el estado físico de las sustancias en una reacción. Esto ayuda a los químicos a entender cómo se comportarán los reactivos y productos bajo ciertas condiciones, lo que es crucial para el diseño y la interpretación de experimentos.
¿Qué es un coeficiente estequiométrico y cómo se utiliza?
Un coeficiente estequiométrico es un número que aparece delante de una fórmula química en una ecuación, indicando la cantidad de moléculas o moles de esa sustancia. Se utiliza para equilibrar ecuaciones químicas y para realizar cálculos sobre la cantidad de reactivos y productos en una reacción.
¿Cómo puedo practicar la escritura de ecuaciones químicas correctamente?
Para practicar la escritura de ecuaciones químicas, comienza con reacciones sencillas y asegúrate de incluir todos los signos auxiliares. Utiliza ejercicios de libros de texto o recursos en línea que ofrezcan problemas y soluciones para reforzar tu comprensión y habilidades.
¿Qué sucede si omito los signos auxiliares al escribir una ecuación?
Omitir los signos auxiliares puede llevar a una interpretación incorrecta de la reacción. Sin esta información, podrías subestimar o sobrestimar las condiciones necesarias para que la reacción ocurra, afectando los resultados de cualquier experimento o análisis.
¿Son los signos auxiliares los mismos en todas las ecuaciones químicas?
Sí, los signos auxiliares son consistentes en todas las ecuaciones químicas. Sin embargo, el contexto de la reacción puede variar, lo que hace que algunos signos sean más relevantes que otros dependiendo de las sustancias involucradas.
¿Cómo afectan los signos de estado a la reacción química?
Los signos de estado afectan a la reacción química porque determinan las condiciones en las que se lleva a cabo la reacción. Por ejemplo, si un reactivo es un gas, puede ser necesario controlar la presión y la temperatura para facilitar la reacción, mientras que un sólido puede requerir condiciones diferentes.
¿Puedo usar los signos auxiliares en reacciones que no son químicas?
Los signos auxiliares son específicos de las ecuaciones químicas y no se utilizan en otros tipos de reacciones, como las físicas. Sin embargo, el concepto de indicar el estado o la cantidad de sustancias puede aplicarse de manera diferente en otros contextos científicos.