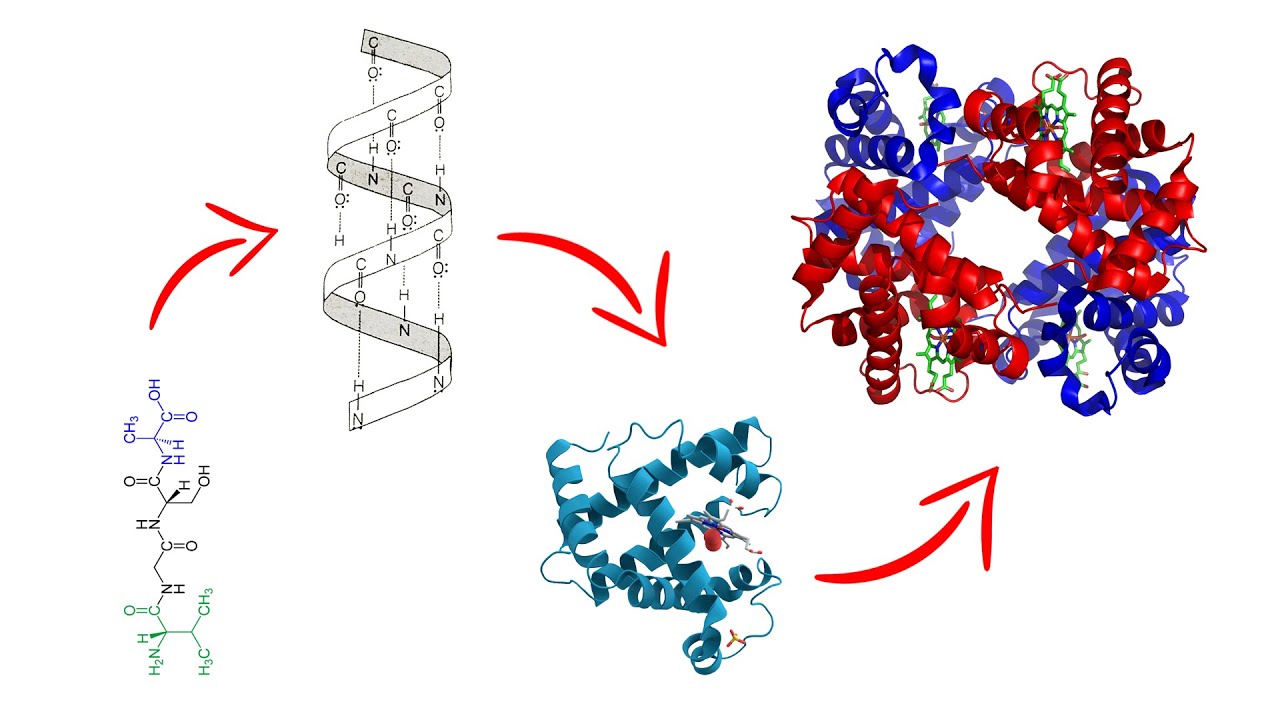
Las proteínas son macromoléculas esenciales para la vida, involucradas en casi todos los procesos biológicos que ocurren en los organismos. Desde la construcción de tejidos hasta la regulación de reacciones químicas, su diversidad funcional se debe a su estructura, que se organiza en diferentes niveles. Comprender los niveles de organización estructural de las proteínas es crucial no solo para los estudiantes de biología, sino también para cualquier persona interesada en la biomedicina, la biotecnología y la investigación científica. En este artículo, exploraremos los cuatro niveles de organización de las proteínas: primaria, secundaria, terciaria y cuaternaria. Además, analizaremos la importancia de cada nivel en la función biológica de las proteínas y cómo alteraciones en estas estructuras pueden tener consecuencias significativas para la salud. Acompáñanos en este recorrido por el fascinante mundo de las proteínas.
Estructura Primaria: La Secuencia de Aminoácidos
La estructura primaria de una proteína se refiere a la secuencia lineal de aminoácidos que la componen. Esta secuencia es fundamental porque determina cómo se pliega la proteína y, por ende, su función. Los aminoácidos se unen mediante enlaces peptídicos, formando una cadena polipeptídica. Existen 20 aminoácidos diferentes que se combinan de diversas maneras, creando una infinita variedad de proteínas. La secuencia específica de aminoácidos es codificada por los genes, lo que significa que cualquier cambio en el ADN puede alterar la proteína resultante.
1 Importancia de la Secuencia de Aminoácidos
La secuencia de aminoácidos es crucial porque pequeñas variaciones pueden tener efectos drásticos en la función de la proteína. Por ejemplo, en la hemoglobina, una mutación en un solo aminoácido puede causar anemia falciforme, una enfermedad genética que afecta la capacidad de la sangre para transportar oxígeno. Este tipo de alteración muestra cómo un cambio en la estructura primaria puede influir en la salud de un individuo. Así, la relación entre la secuencia de aminoácidos y la función proteica es un aspecto central en biología molecular y medicina.
2 Métodos de Estudio de la Estructura Primaria
Los científicos utilizan diversas técnicas para determinar la estructura primaria de las proteínas. Una de las más comunes es la secuenciación de proteínas, que implica la identificación del orden de los aminoácidos en una cadena polipeptídica. Métodos como la espectrometría de masas y la secuenciación por ADN son herramientas valiosas en este proceso. Estos avances han permitido no solo estudiar proteínas individuales, sino también comprender las interacciones entre diferentes proteínas en sistemas biológicos complejos.
Estructura Secundaria: Plegados Locales
La estructura secundaria de las proteínas se refiere a los patrones de plegado que se forman en segmentos de la cadena polipeptídica debido a enlaces de hidrógeno entre los átomos de oxígeno y nitrógeno de los enlaces peptídicos. Los dos tipos más comunes de estructuras secundarias son las hélices alfa y las láminas beta. Estos pliegues son fundamentales para la estabilidad y la funcionalidad de la proteína, ya que crean un marco estructural que soporta la forma tridimensional de la proteína.
1 Hélices Alfa y Láminas Beta
Las hélices alfa son estructuras en espiral que se estabilizan por enlaces de hidrógeno entre aminoácidos que están separados por cuatro posiciones en la cadena. Este tipo de estructura es común en proteínas que requieren elasticidad y flexibilidad, como la queratina en el cabello y las uñas. Por otro lado, las láminas beta se forman cuando segmentos de la cadena se alinean y se estabilizan por enlaces de hidrógeno entre cadenas adyacentes. Este tipo de estructura es típico en proteínas que necesitan ser rígidas y fuertes, como el colágeno en los tejidos conectivos.
2 Impacto de la Estructura Secundaria en la Función
La estructura secundaria no solo proporciona estabilidad, sino que también influye en cómo interactúan las proteínas con otras moléculas. Por ejemplo, la flexibilidad de las hélices alfa permite que las proteínas se adapten a diferentes ligandos, mientras que la rigidez de las láminas beta puede ser crucial para mantener la forma de la proteína durante funciones específicas. La comprensión de estas estructuras es esencial en el diseño de fármacos, donde se busca crear compuestos que se unan a proteínas específicas y modifiquen su actividad.
Estructura Terciaria: La Conformación Global
La estructura terciaria se refiere a la forma tridimensional completa de una proteína, que resulta del plegamiento de la cadena polipeptídica en el espacio. Esta conformación es el resultado de interacciones entre los grupos laterales de los aminoácidos, que pueden incluir enlaces iónicos, interacciones hidrofóbicas, puentes de hidrógeno y fuerzas de Van der Waals. La estructura terciaria es crucial porque determina la función de la proteína y su capacidad para interactuar con otras moléculas.
1 Factores que Influyen en el Plegamiento Terciario
El plegamiento de las proteínas en su estructura terciaria es un proceso complejo que puede ser influenciado por diversos factores, incluyendo el pH, la temperatura y la concentración de sales. Por ejemplo, un cambio en el pH puede alterar la carga de los grupos laterales de los aminoácidos, lo que puede afectar la forma final de la proteína. Además, la presencia de chaperonas, que son proteínas que ayudan a otras proteínas a plegarse correctamente, juega un papel fundamental en la correcta formación de la estructura terciaria.
2 Importancia de la Estructura Terciaria en la Función Biológica
La estructura terciaria es crítica para la función biológica de las proteínas. Por ejemplo, las enzimas, que son proteínas que catalizan reacciones químicas, dependen de su forma tridimensional para unirse a sus sustratos de manera específica. Si la estructura terciaria se desnaturaliza, como ocurre con el calor extremo o cambios en el pH, la enzima puede perder su actividad. Esto resalta la importancia de la estabilidad estructural en el funcionamiento de las proteínas dentro de las células.
Estructura Cuaternaria: Complejos de Múltiples Cadenas
La estructura cuaternaria se refiere a la asociación de múltiples cadenas polipeptídicas o subunidades para formar una proteína funcional. No todas las proteínas tienen esta estructura; aquellas que la poseen suelen ser complejos que requieren la interacción de varias subunidades para realizar su función. Un ejemplo clásico es la hemoglobina, que consta de cuatro subunidades que trabajan juntas para transportar oxígeno en la sangre.
1 Tipos de Interacciones en la Estructura Cuaternaria
Las interacciones que mantienen unidas las subunidades en una estructura cuaternaria incluyen enlaces iónicos, interacciones hidrofóbicas y enlaces de hidrógeno, similares a los que se encuentran en las estructuras secundarias y terciarias. Estas interacciones son cruciales para la estabilidad del complejo y su funcionalidad. Un cambio en la concentración de iones o en la temperatura puede afectar estas interacciones, lo que a su vez puede alterar la actividad de la proteína.
2 Ejemplos de Proteínas con Estructura Cuaternaria
Además de la hemoglobina, otros ejemplos de proteínas con estructura cuaternaria incluyen la inmunoglobulina y la fibrina. La inmunoglobulina, que juega un papel clave en el sistema inmunológico, está formada por cuatro cadenas polipeptídicas que se unen para formar un anticuerpo. Por otro lado, la fibrina es fundamental en la coagulación sanguínea y se forma a partir de subunidades que se ensamblan en respuesta a una lesión. La estructura cuaternaria es, por lo tanto, esencial para la función de estas proteínas en procesos biológicos críticos.
Alteraciones en la Estructura de las Proteínas: Implicaciones para la Salud
Las alteraciones en cualquiera de los niveles de organización estructural de las proteínas pueden llevar a una pérdida de función, lo que a menudo se traduce en enfermedades. Las mutaciones genéticas, los cambios ambientales o el mal plegamiento pueden afectar gravemente la estructura y, por ende, la función de las proteínas. Este fenómeno es fundamental en muchas enfermedades, incluidas las neurodegenerativas como el Alzheimer y el Parkinson, donde el mal plegamiento de proteínas genera agregados tóxicos.
1 Enfermedades Relacionadas con el Mal Plegamiento de Proteínas
El mal plegamiento de proteínas puede dar lugar a diversas enfermedades. Por ejemplo, en el Alzheimer, las proteínas beta-amiloides se agregan formando placas que interfieren con la comunicación neuronal. En el caso del Parkinson, la proteína alfa-sinucleína se agrupa en cuerpos de Lewy, afectando la función celular. Estos ejemplos ilustran cómo la comprensión de los niveles de organización estructural de las proteínas es crucial para desarrollar terapias efectivas y estrategias de tratamiento.
2 Estrategias para Corregir el Mal Plegamiento
La investigación en biomedicina busca constantemente nuevas formas de corregir o prevenir el mal plegamiento de proteínas. Se están desarrollando fármacos que actúan como chaperonas, ayudando a las proteínas a plegarse correctamente. Además, la terapia génica ofrece la posibilidad de corregir mutaciones en el ADN que causan alteraciones en la estructura de las proteínas. Estas estrategias son esperanzadoras y representan un avance en el tratamiento de enfermedades relacionadas con el mal plegamiento.
¿Qué son las proteínas y cuál es su función en el organismo?
Las proteínas son macromoléculas compuestas por cadenas de aminoácidos y son esenciales para la estructura, función y regulación de los tejidos y órganos del cuerpo. Desempeñan roles vitales como enzimas, hormonas, anticuerpos y estructuras celulares. Su versatilidad permite que participen en prácticamente todos los procesos biológicos.
¿Cómo se determina la estructura de una proteína?
La estructura de una proteína se determina mediante técnicas como la cristalografía de rayos X, la espectrometría de masas y la resonancia magnética nuclear (RMN). Estas técnicas permiten a los científicos visualizar la disposición de los átomos en la proteína y comprender cómo se pliega en sus diferentes niveles estructurales.
¿Por qué es importante la estructura cuaternaria de las proteínas?
La estructura cuaternaria es importante porque permite que múltiples subunidades se asocien y trabajen juntas para realizar funciones específicas. Esta colaboración es esencial en proteínas como la hemoglobina, donde la unión de oxígeno requiere la interacción de varias subunidades. Sin esta estructura, la proteína no podría cumplir su función correctamente.
¿Qué sucede si una proteína se desnaturaliza?
La desnaturalización de una proteína implica la pérdida de su estructura tridimensional, lo que resulta en la pérdida de su función. Esto puede ocurrir debido a cambios en la temperatura, pH o presencia de agentes químicos. Las proteínas desnaturalizadas pueden volverse inactivas y, en algunos casos, pueden formar agregados que son perjudiciales para las células.
¿Cómo se relaciona la estructura de las proteínas con las enfermedades?
Las alteraciones en la estructura de las proteínas pueden llevar a enfermedades. Por ejemplo, el mal plegamiento de proteínas puede causar enfermedades neurodegenerativas como el Alzheimer y el Parkinson. Comprender los niveles de organización estructural de las proteínas es esencial para desarrollar tratamientos que aborden estas condiciones.
¿Existen técnicas para reparar proteínas mal plegadas?
Sí, existen técnicas en desarrollo que buscan corregir el mal plegamiento de proteínas. Esto incluye el uso de fármacos que actúan como chaperonas para ayudar a las proteínas a plegarse correctamente y enfoques de terapia génica para corregir mutaciones que causan alteraciones en la estructura de las proteínas. Estas estrategias representan un avance significativo en el tratamiento de enfermedades relacionadas con el mal plegamiento.