La biología molecular se encuentra en el corazón de muchas de las funciones vitales de los organismos vivos, y las proteínas son uno de sus componentes más cruciales. La estructura terciaria de las proteínas es una de las etapas más complejas en la formación de estas moléculas, donde se determina su funcionalidad y actividad biológica. En este artículo, exploraremos a fondo qué es la estructura terciaria, cómo se forma y por qué la hoja plegada, un elemento fundamental en esta estructura, juega un papel tan importante. Además, discutiremos la relevancia de estos conceptos en la investigación científica y en aplicaciones prácticas como la biotecnología y la medicina. Al final, tendrás una comprensión clara de cómo la estructura terciaria de las proteínas, y en particular la hoja plegada, son esenciales para la vida tal como la conocemos.
¿Qué es la Estructura Terciaria de las Proteínas?
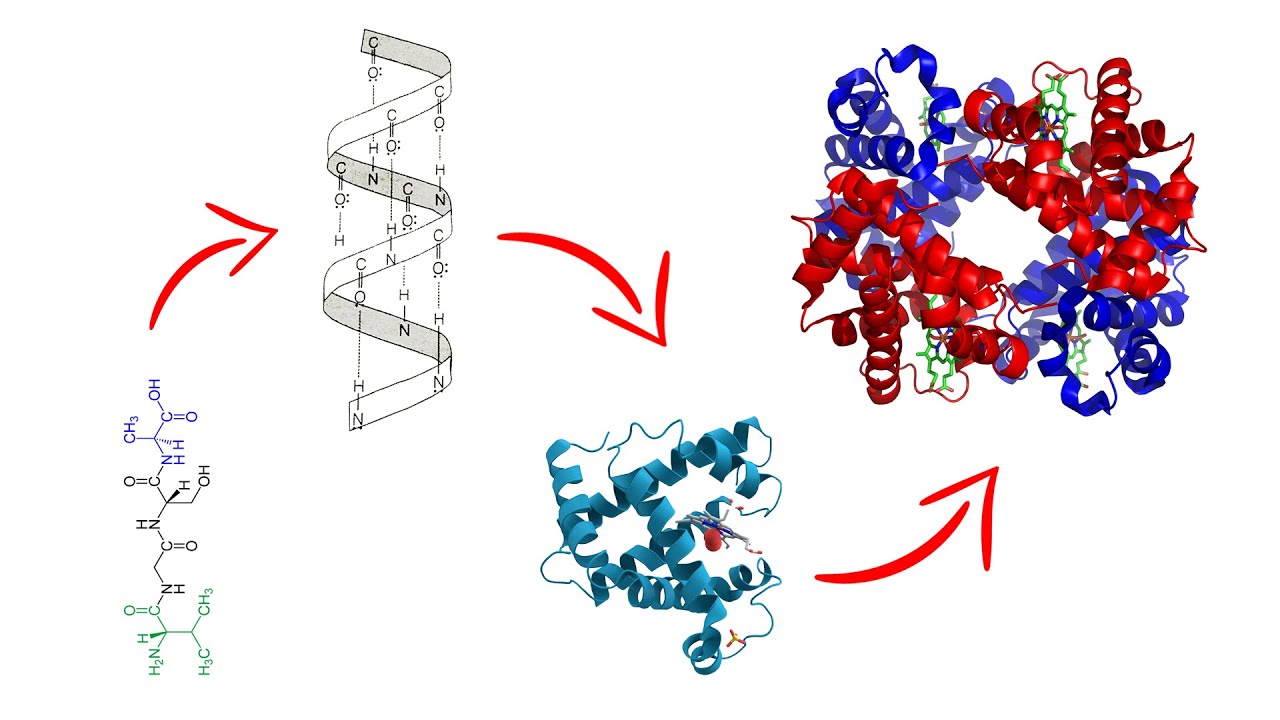
La estructura terciaria de una proteína se refiere a su conformación tridimensional final, que es crucial para su función biológica. Esta estructura se forma a partir de interacciones complejas entre los grupos R de los aminoácidos que componen la cadena polipeptídica. La combinación de enlaces de hidrógeno, interacciones hidrofóbicas, puentes disulfuro y fuerzas de Van der Waals contribuyen a la estabilidad de esta estructura. La formación de la estructura terciaria es un proceso dinámico que puede verse afectado por factores como el pH, la temperatura y la concentración de iones.
Características Clave de la Estructura Terciaria
La estructura terciaria se caracteriza por varios elementos que son esenciales para su funcionalidad:
- Interacciones Hidrofóbicas: Los aminoácidos hidrofóbicos tienden a agruparse en el interior de la proteína, alejándose del agua, lo que contribuye a la estabilidad de la estructura.
- Puentes Disulfuro: Estos enlaces covalentes se forman entre los grupos sulfhidrilo de cisteínas, proporcionando una estabilidad adicional a la estructura.
- Interacciones Iónicas: Los grupos cargados positivamente y negativamente pueden atraer o repeler entre sí, influenciando la forma final de la proteína.
La combinación de estas interacciones resulta en una conformación única que es crítica para la función de la proteína. Por ejemplo, las enzimas, que son proteínas que catalizan reacciones químicas, dependen de su estructura terciaria para reconocer y unirse a sus sustratos específicos.
La Hoja Plegada: Un Componente Fundamental
Dentro de la estructura terciaria, uno de los elementos más interesantes es la hoja plegada. Este motivo estructural se forma cuando cadenas de polipéptidos se organizan en una serie de pliegues paralelos o antiparalelos, estabilizados por enlaces de hidrógeno entre los grupos carbonilo y amino de los aminoácidos. La hoja plegada puede ser un componente esencial en la arquitectura de muchas proteínas, incluyendo las que tienen funciones estructurales, enzimáticas y de transporte.
Tipos de Hoja Plegada
Existen dos tipos principales de hojas plegadas: la hoja plegada paralela y la antiparalela.
- Hoja Plegada Paralela: En este tipo, las cadenas de aminoácidos corren en la misma dirección. Esto permite una mayor estabilidad gracias a la proximidad de los enlaces de hidrógeno.
- Hoja Plegada Antiparalela: Aquí, las cadenas corren en direcciones opuestas, lo que también permite la formación de enlaces de hidrógeno, pero con una geometría diferente que puede influir en la estabilidad general de la estructura.
Ambos tipos de hojas plegadas son cruciales para la funcionalidad de muchas proteínas, y su presencia puede determinar cómo una proteína interactúa con otras moléculas. Por ejemplo, en las proteínas de almacenamiento, como la albúmina, la disposición de la hoja plegada permite la unión eficiente de ligandos.
La Importancia de la Estructura Terciaria en la Función Proteica
La estructura terciaria no solo define la forma de la proteína, sino que también es determinante para su función. Cada proteína tiene un rol específico en el organismo, y cualquier alteración en su estructura terciaria puede afectar su actividad. Esto es particularmente relevante en el contexto de enfermedades. Por ejemplo, muchas enfermedades genéticas y neurodegenerativas están relacionadas con proteínas mal plegadas, como la enfermedad de Alzheimer, donde la acumulación de proteínas mal plegadas lleva a la formación de placas que interrumpen la comunicación neuronal.
Ejemplos de Funciones Proteicas Dependientes de la Estructura Terciaria
Algunos ejemplos de cómo la estructura terciaria influye en la función de las proteínas son:
- Enzimas: La actividad catalítica de una enzima está directamente relacionada con su estructura terciaria. Cambios en la conformación pueden llevar a una pérdida de actividad.
- Anticuerpos: La estructura terciaria de los anticuerpos les permite reconocer y unirse a antígenos específicos, lo que es crucial para la respuesta inmune.
- Proteínas de Transporte: Proteínas como la hemoglobina dependen de su estructura terciaria para transportar oxígeno de manera eficiente a través del torrente sanguíneo.
Estos ejemplos destacan la interconexión entre la estructura y la función, mostrando cómo la biología molecular es un delicado equilibrio de formas y funciones que se han optimizado a lo largo de la evolución.
Factores que Afectan la Estructura Terciaria de las Proteínas
La estabilidad de la estructura terciaria puede verse afectada por diversos factores ambientales y químicos. Comprender estos factores es esencial para la investigación en biología molecular y biotecnología.
Condiciones Ambientales
Las condiciones como el pH y la temperatura pueden influir en la estructura terciaria. Por ejemplo:
- pH: Un cambio en el pH puede alterar las cargas en los grupos R de los aminoácidos, afectando las interacciones iónicas y la estabilidad general de la proteína.
- Temperatura: A temperaturas elevadas, las proteínas pueden desnaturalizarse, perdiendo su estructura terciaria y, por lo tanto, su funcionalidad.
Agentes Desnaturalizantes
Además de las condiciones ambientales, ciertos agentes químicos pueden desnaturalizar proteínas. Estos incluyen:
- Detergentes: Pueden interrumpir las interacciones hidrofóbicas que estabilizan la estructura terciaria.
- Solventes Orgánicos: Pueden afectar las interacciones entre los grupos funcionales de los aminoácidos, provocando la desnaturalización.
El estudio de estos factores es vital en la biotecnología, donde se busca optimizar las condiciones para la producción de proteínas recombinantes con funciones específicas.
Aplicaciones de la Comprensión de la Estructura Terciaria
El conocimiento sobre la estructura terciaria de las proteínas tiene amplias aplicaciones en diversos campos, incluyendo la medicina, la biotecnología y la investigación biomédica.
Desarrollo de Fármacos
La comprensión de cómo se pliegan las proteínas y cómo su estructura terciaria afecta su función es fundamental en el diseño de fármacos. Los investigadores pueden diseñar moléculas que se unan a sitios específicos en las proteínas, inhibiendo o potenciando su actividad. Por ejemplo, en el tratamiento del cáncer, se están desarrollando inhibidores que se dirigen a proteínas específicas involucradas en la proliferación celular.
Ingeniería de Proteínas
La ingeniería de proteínas es otra área donde la comprensión de la estructura terciaria es crucial. Al modificar la secuencia de aminoácidos de una proteína, los científicos pueden crear variantes con propiedades mejoradas, como mayor estabilidad o actividad en condiciones extremas. Esto tiene aplicaciones en la producción de enzimas industriales y en la creación de biocombustibles.
¿Qué es la diferencia entre la estructura secundaria y terciaria de las proteínas?
La estructura secundaria se refiere a la organización local de la cadena polipeptídica, como hélices alfa y hojas plegadas, mientras que la estructura terciaria es la conformación tridimensional completa de la proteína, que incluye interacciones entre todas las partes de la cadena.
¿Por qué es importante la hoja plegada en la estructura terciaria?
La hoja plegada proporciona estabilidad y es un componente clave en muchas proteínas funcionales. Su formación permite que las proteínas adopten formas que son esenciales para su actividad biológica.
¿Cómo afecta la temperatura a la estructura terciaria de las proteínas?
Temperaturas elevadas pueden causar desnaturalización, donde la proteína pierde su estructura terciaria y, por ende, su función. Esto puede ser irreversible en algunos casos, dependiendo de la proteína y las condiciones.
¿Qué enfermedades están relacionadas con proteínas mal plegadas?
Las enfermedades como el Alzheimer, Parkinson y algunas formas de cáncer están asociadas con el mal plegamiento de proteínas, lo que lleva a la acumulación de formas no funcionales que pueden ser tóxicas para las células.
¿Se pueden revertir los efectos de la desnaturalización de proteínas?
En algunos casos, si las condiciones que causaron la desnaturalización se revierten, las proteínas pueden renaturalizarse y recuperar su funcionalidad. Sin embargo, esto no siempre es posible, especialmente si se han formado agregados irreversibles.
¿Cómo se estudia la estructura terciaria de las proteínas?
Los métodos como la cristalografía de rayos X, la resonancia magnética nuclear (RMN) y la espectroscopía de masas son técnicas comunes para estudiar la estructura terciaria de las proteínas y entender su conformación y funcionalidad.
¿Cuál es el papel de la estructura terciaria en la biotecnología?
La comprensión de la estructura terciaria permite a los científicos diseñar proteínas con funciones específicas, mejorar la producción de enzimas para aplicaciones industriales y desarrollar tratamientos médicos más eficaces.