La geometría molecular es un concepto fundamental en la química que se refiere a la disposición tridimensional de los átomos en una molécula. Comprender la geometría molecular es esencial no solo para los químicos, sino también para cualquier persona interesada en cómo funcionan las sustancias a nivel atómico. La forma en que se organizan los átomos en una molécula influye en sus propiedades físicas y químicas, como la polaridad, la reactividad y el comportamiento en soluciones. En este artículo, exploraremos las características de la geometría molecular, su importancia y cómo se determina, así como los modelos que se utilizan para describirla. Además, responderemos a preguntas comunes sobre el tema, lo que te permitirá tener una visión completa y clara de este fascinante aspecto de la química.
¿Qué es la Geometría Molecular?
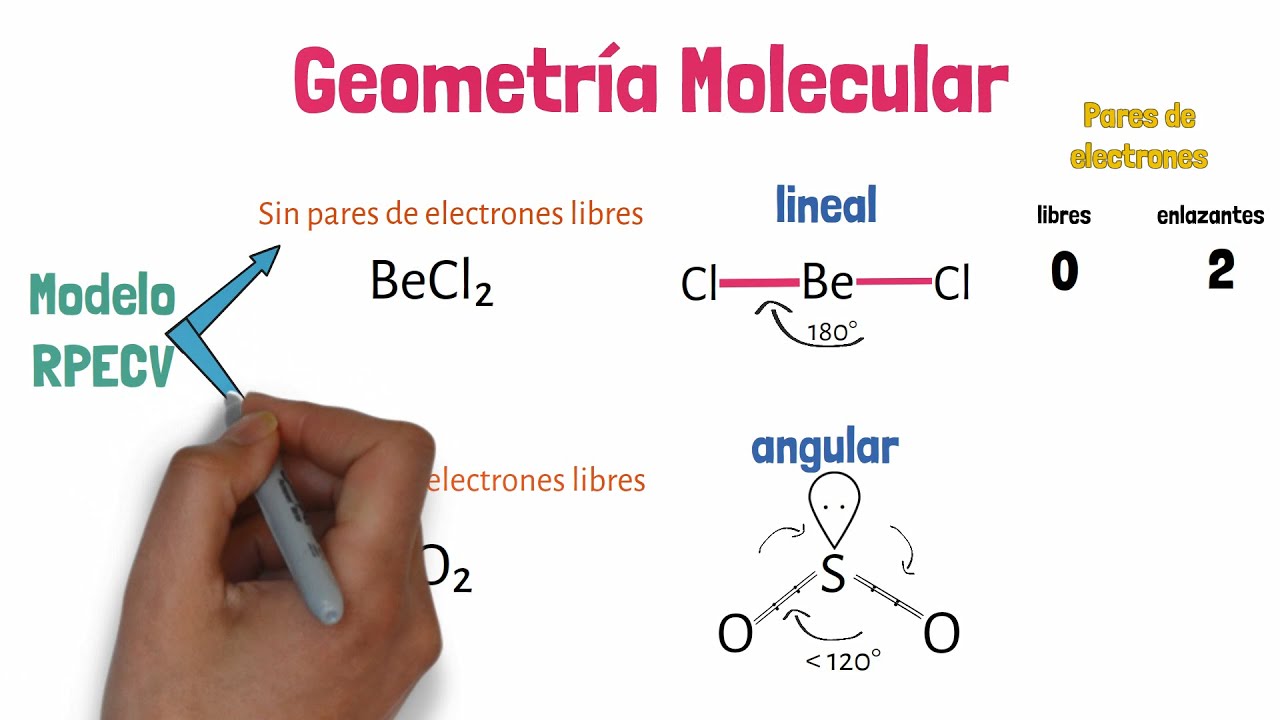
La geometría molecular se refiere a la disposición de los átomos en una molécula y se determina por la interacción entre los electrones de los átomos. Esta disposición no solo afecta la forma de la molécula, sino también sus propiedades. La geometría molecular se puede entender a través de varios modelos y teorías que describen cómo los átomos se organizan en el espacio. La teoría de repulsión de pares de electrones de la capa de valencia (VSEPR) es una de las más utilizadas para predecir la geometría molecular.
Teoría VSEPR
La teoría VSEPR postula que los pares de electrones alrededor de un átomo central se disponen en el espacio para minimizar la repulsión entre ellos. Esto se traduce en formas geométricas específicas que se pueden clasificar en varias categorías. Por ejemplo, en una molécula como el metano (CH₄), el carbono está rodeado por cuatro átomos de hidrógeno, y la geometría adoptada es tetraédrica, donde los átomos de hidrógeno se sitúan en los vértices de un tetraedro.
Otro ejemplo es el agua (H₂O), que tiene una geometría angular. A pesar de que el oxígeno está rodeado por dos pares de electrones de enlace, la repulsión entre los pares de electrones no enlazantes (lone pairs) provoca que los átomos de hidrógeno se acerquen entre sí, formando un ángulo de aproximadamente 104.5 grados. Este ángulo es crucial para entender la polaridad del agua y sus propiedades como solvente.
Factores que Afectan la Geometría Molecular
La geometría molecular no es solo el resultado de la teoría VSEPR; varios factores influyen en cómo se organiza una molécula. Estos incluyen la electronegatividad, la hibridación y la presencia de pares de electrones no compartidos. Comprender estos factores es clave para predecir la geometría de diferentes moléculas.
Electronegatividad
La electronegatividad se refiere a la tendencia de un átomo a atraer electrones hacia sí mismo. En moléculas donde hay una gran diferencia de electronegatividad entre los átomos, como en el caso del cloruro de hidrógeno (HCl), la distribución de electrones no es uniforme. Esta diferencia afecta no solo la polaridad de la molécula, sino también su geometría. Por ejemplo, en compuestos como el H₂O, la alta electronegatividad del oxígeno en comparación con el hidrógeno crea un dipolo eléctrico, lo que resulta en una geometría angular.
Hibridación
La hibridación es el proceso mediante el cual los orbitales atómicos se combinan para formar nuevos orbitales híbridos. Esto es crucial para entender la geometría molecular, ya que la hibridación determina cómo se distribuyen los enlaces. Por ejemplo, en el etileno (C₂H₄), los carbonos están hibridados en sp², lo que les permite formar enlaces dobles y adoptar una geometría plana trigonal. Este concepto es fundamental para la química orgánica y la comprensión de compuestos más complejos.
Clasificación de las Geometrías Moleculares
Existen diversas geometrías moleculares que se pueden clasificar según la cantidad de átomos alrededor del átomo central y los pares de electrones no compartidos. A continuación, describimos algunas de las más comunes:
- Tetraédrica: Cuatro pares de electrones se distribuyen en los vértices de un tetraedro. Ejemplo: CH₄.
- Trigonal plana: Tres pares de electrones se distribuyen en un plano, formando ángulos de 120 grados. Ejemplo: BF₃.
- Angular: Dos pares de electrones de enlace y un par de electrones no compartidos, como en H₂O.
- Lineal: Dos pares de electrones de enlace, como en CO₂.
La clasificación de la geometría molecular es vital para entender cómo las moléculas interactúan entre sí y con su entorno. Las diferentes formas pueden influir en la reactividad y en cómo las moléculas se ensamblan en estructuras más grandes, como proteínas o polímeros.
Propiedades de las Moléculas según su Geometría
La geometría molecular tiene un impacto significativo en las propiedades físicas y químicas de las sustancias. Las características como la polaridad, el punto de ebullición, la solubilidad y la reactividad están intrínsecamente ligadas a la forma de la molécula.
Polaridad
La polaridad de una molécula se determina por la distribución de electrones y la geometría. Las moléculas con una geometría asimétrica, como el agua, son polares, mientras que las simétricas, como el dióxido de carbono, son apolares. Esta diferencia en polaridad es esencial para entender cómo las moléculas interactúan en soluciones y reacciones químicas.
Punto de Ebullición y Solubilidad
Las moléculas polares tienden a tener puntos de ebullición más altos debido a las fuerzas intermoleculares, como los enlaces de hidrógeno. Por ejemplo, el agua tiene un punto de ebullición elevado comparado con otros compuestos de peso molecular similar. Además, la solubilidad de una sustancia en un solvente está relacionada con su geometría; las moléculas polares se disuelven bien en solventes polares, mientras que las apolares son más solubles en solventes apolares.
Modelos de Geometría Molecular
Existen varios modelos que se utilizan para visualizar y entender la geometría molecular. Estos modelos permiten a los químicos predecir y explicar la forma de las moléculas de manera más efectiva.
Modelos de Bolas y Varillas
Los modelos de bolas y varillas son herramientas visuales que representan átomos como esferas y enlaces como varillas. Estos modelos son útiles para visualizar la geometría de moléculas simples y complejas. A través de ellos, se pueden apreciar las distancias entre átomos y la disposición espacial de los enlaces, facilitando la comprensión de la estructura molecular.
Modelos Computacionales
Con el avance de la tecnología, los modelos computacionales se han vuelto cada vez más importantes en la química. Estos modelos utilizan simulaciones para predecir la geometría y las propiedades de las moléculas, permitiendo a los investigadores explorar estructuras que pueden ser difíciles de sintetizar en el laboratorio. Las simulaciones pueden ayudar a visualizar interacciones moleculares y predecir la reactividad química de forma precisa.
¿Por qué es importante la geometría molecular?
La geometría molecular es fundamental porque determina cómo interactúan las moléculas entre sí. Esta interacción afecta propiedades como la polaridad, la reactividad y el comportamiento en soluciones, lo que es crucial en diversas aplicaciones químicas y biológicas.
¿Cómo se determina la geometría de una molécula?
La geometría de una molécula se determina principalmente a través de la teoría VSEPR, que considera la repulsión entre pares de electrones. También se pueden usar métodos de hibridación y modelos computacionales para obtener una representación precisa de la estructura molecular.
¿Qué es un par de electrones no compartidos?
Un par de electrones no compartidos, también conocido como par solitario, son electrones en un átomo que no participan en la formación de enlaces. Estos pares influyen en la geometría molecular al causar repulsiones que alteran la disposición de los átomos en la molécula.
¿Qué relación hay entre geometría y polaridad?
La geometría de una molécula influye en su polaridad. Las moléculas con geometrías asimétricas suelen ser polares, mientras que las simétricas tienden a ser apolares. Esta polaridad es crucial para determinar cómo interactúan las moléculas en diversas situaciones químicas.
¿Cuáles son algunos ejemplos de geometrías moleculares comunes?
Algunos ejemplos de geometrías moleculares incluyen tetraédrica (CH₄), trigonal plana (BF₃), angular (H₂O) y lineal (CO₂). Cada una de estas geometrías tiene características únicas que afectan las propiedades de las moléculas.
¿Qué papel juega la hibridación en la geometría molecular?
La hibridación describe cómo los orbitales atómicos se combinan para formar nuevos orbitales que determinan la geometría de la molécula. Diferentes tipos de hibridación (sp, sp², sp³) dan lugar a distintas disposiciones geométricas y enlaces entre átomos.
¿Cómo afecta la geometría molecular a la biología?
La geometría molecular es crucial en biología, ya que determina la forma y función de biomoléculas como proteínas y ácidos nucleicos. La forma de estas moléculas influye en cómo interactúan con otras moléculas, lo que es esencial para procesos biológicos como la enzima-substrato y la replicación del ADN.