Cuando hablamos de la estructura de la materia, los átomos son los bloques fundamentales que la componen. Pero, ¿sabías que existen átomos que, a pesar de tener el mismo número atómico, pueden presentar diferentes propiedades? Esto ocurre debido a la variación en el número másico, un concepto clave en la química y la física nuclear. En este artículo, exploraremos en profundidad el fascinante mundo de los átomos con el mismo número atómico pero diferente número másico, conocidos como isótopos. A lo largo de nuestras secciones, descubrirás qué son, cómo se forman, sus aplicaciones en la vida diaria y mucho más. Prepárate para sumergirte en un tema que no solo es relevante para los científicos, sino también para cualquier persona interesada en entender mejor la naturaleza de nuestro universo.
¿Qué es el Número Atómico y el Número Másico?
Para entender los átomos con el mismo número atómico pero diferente número másico, es fundamental definir primero qué significan estos términos.
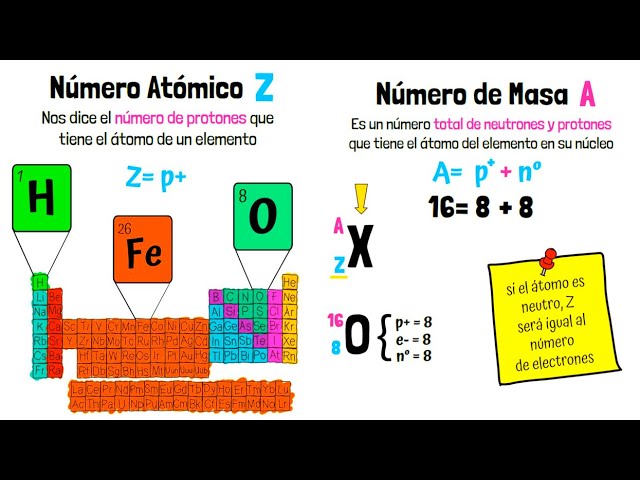
1 Definición de Número Atómico
El número atómico (Z) es el número que indica la cantidad de protones en el núcleo de un átomo. Este número es crucial porque determina la identidad del elemento químico. Por ejemplo, el hidrógeno tiene un número atómico de 1, lo que significa que tiene un protón. El carbono, por otro lado, tiene un número atómico de 6, ya que contiene seis protones. Además, el número atómico también influye en las propiedades químicas del elemento, ya que determina cómo interactúa con otros átomos.
2 Definición de Número Másico
El número másico (A) se refiere a la suma de protones y neutrones en el núcleo de un átomo. A diferencia del número atómico, el número másico puede variar entre diferentes isótopos de un mismo elemento. Por ejemplo, el carbono tiene un número másico de 12 en su forma más común, conocida como carbono-12 (6 protones y 6 neutrones), pero también existe el carbono-14, que tiene 6 protones y 8 neutrones, lo que le da un número másico de 14. Esta diferencia en el número másico es lo que define a los isótopos.
Isótopos: La Clave para Entender la Variación en el Número Másico
Los isótopos son átomos de un mismo elemento que tienen el mismo número atómico pero diferente número másico. Esta variación en el número másico se debe a la diferente cantidad de neutrones en el núcleo. A continuación, exploraremos más sobre los isótopos y su importancia.
1 Tipos de Isótopos
Los isótopos se pueden clasificar en dos categorías principales: isótopos estables e inestables. Los isótopos estables no sufren descomposición radiactiva, mientras que los inestables, o radiactivos, lo hacen, liberando energía en forma de radiación.
- Isótopos Estables: Ejemplos de estos son el carbono-12 y el oxígeno-16. Estos isótopos no se descomponen y son comunes en la naturaleza.
- Isótopos Inestables: Un ejemplo famoso es el carbono-14, que es radiactivo y se utiliza en la datación de materiales orgánicos.
2 Formación de Isótopos
Los isótopos se forman de varias maneras, incluyendo procesos naturales y artificiales. En la naturaleza, algunos elementos tienen varios isótopos debido a la estabilidad de sus núcleos. En otros casos, los isótopos se producen en laboratorios mediante reacciones nucleares. Por ejemplo, los isótopos radiactivos pueden generarse al bombardear átomos con partículas subatómicas.
Aplicaciones de los Isótopos en la Ciencia y la Tecnología
Los isótopos tienen una amplia gama de aplicaciones en diferentes campos, desde la medicina hasta la arqueología. A continuación, exploraremos algunas de las aplicaciones más significativas.
1 Medicina Nuclear
En el campo de la medicina, los isótopos radiactivos se utilizan en diagnósticos y tratamientos. Por ejemplo, el yodo-131 se usa para tratar enfermedades de la tiroides, mientras que el tecnecio-99m es común en imágenes médicas, permitiendo a los médicos obtener imágenes detalladas de órganos y tejidos.
2 Datación Radiométrica
La datación radiométrica es una técnica que utiliza isótopos radiactivos para determinar la edad de materiales. El carbono-14 es el isótopo más conocido para este propósito, permitiendo a los arqueólogos datar restos orgánicos de hasta 50,000 años. Este método ha sido fundamental para entender la historia de la humanidad y la evolución de las especies.
3 Investigación Científica
Los isótopos también se utilizan en investigaciones científicas para rastrear procesos químicos y biológicos. Por ejemplo, los isótopos estables se pueden usar como trazadores para estudiar el movimiento de agua en el medio ambiente o el metabolismo en organismos vivos. Esto proporciona información valiosa sobre cómo interactúan los elementos en diferentes sistemas.
Ejemplos de Isótopos en la Naturaleza
Existen numerosos ejemplos de isótopos en la naturaleza, algunos de los cuales son de gran relevancia para nuestra vida cotidiana. A continuación, examinaremos algunos de los más comunes.
1 Hidrógeno
El hidrógeno tiene tres isótopos: hidrógeno-1 (protium), hidrógeno-2 (deuterio) y hidrógeno-3 (tritio). Mientras que el protium es el más común y estable, el deuterio se utiliza en la investigación de reacciones químicas y el tritio es radiactivo, utilizado en aplicaciones de energía nuclear.
2 Carbono
El carbono tiene varios isótopos, siendo el carbono-12 y el carbono-14 los más conocidos. El carbono-12 es estable y constituye la mayoría del carbono en la naturaleza, mientras que el carbono-14 es inestable y se utiliza para la datación de materiales orgánicos.
3 Uranio
El uranio tiene varios isótopos, siendo el uranio-238 y el uranio-235 los más importantes. El uranio-238 es el isótopo más abundante y se utiliza en reactores nucleares, mientras que el uranio-235 es el isótopo fisible utilizado en armas nucleares y energía nuclear.
El Impacto de los Isótopos en la Investigación Científica
Los isótopos han revolucionado nuestra comprensión de muchos procesos científicos. Desde la biología hasta la geología, su uso ha permitido avances significativos en diversas disciplinas.
1 Biología y Ecología
En biología, los isótopos se utilizan para rastrear la dieta de los organismos y comprender las cadenas alimenticias. Por ejemplo, los isótopos estables de carbono y nitrógeno se pueden analizar en tejidos biológicos para determinar las fuentes de alimento de un organismo. Esto ayuda a los ecólogos a comprender mejor las interacciones en los ecosistemas.
2 Geología
En geología, los isótopos se utilizan para estudiar la formación de rocas y la historia de la Tierra. La datación de isótopos radiactivos permite a los geólogos determinar la edad de las formaciones rocosas y los eventos geológicos, como erupciones volcánicas o la formación de montañas.
3 Física Nuclear
En física nuclear, los isótopos son esenciales para la investigación de la estructura del núcleo atómico y las reacciones nucleares. Estudiar isótopos inestables proporciona información sobre las fuerzas que mantienen unido el núcleo y cómo se producen las reacciones nucleares, lo que es fundamental para el desarrollo de nuevas tecnologías de energía.
Mitos y Realidades sobre los Isótopos
Los isótopos a menudo son objeto de malentendidos y mitos. En esta sección, desmitificaremos algunas creencias comunes.
1 Isótopos y Radiactividad
Un mito común es que todos los isótopos son radiactivos. En realidad, solo una fracción de los isótopos es inestable. La mayoría de los elementos en la tabla periódica tienen isótopos estables que no presentan riesgos de radiación.
2 Uso de Isótopos en la Medicina
Otro mito es que el uso de isótopos radiactivos en medicina siempre conlleva riesgos. Si bien es cierto que hay precauciones que tomar, los isótopos radiactivos se utilizan en dosis controladas y han demostrado ser seguros y efectivos en el diagnóstico y tratamiento de enfermedades.
3 Isótopos y Cambio Climático
Algunas personas creen que los isótopos no tienen relevancia en la lucha contra el cambio climático. Sin embargo, el estudio de isótopos estables en gases de efecto invernadero ayuda a los científicos a comprender las fuentes y los procesos que contribuyen al cambio climático, lo que es esencial para desarrollar estrategias efectivas de mitigación.
FAQ (Preguntas Frecuentes)
¿Qué son los isótopos y por qué son importantes?
Los isótopos son átomos de un mismo elemento que tienen el mismo número atómico pero diferente número másico. Son importantes porque permiten una comprensión más profunda de la química y la física, y tienen aplicaciones prácticas en campos como la medicina, la arqueología y la investigación científica.
¿Cómo se utilizan los isótopos en la medicina?
Los isótopos radiactivos se utilizan en medicina para diagnósticos y tratamientos. Por ejemplo, se emplean en imágenes médicas y en terapias para enfermedades como el cáncer. Estos isótopos permiten a los médicos obtener información detallada sobre la salud del paciente y dirigir tratamientos específicos.
¿Cuáles son los isótopos más comunes?
Algunos de los isótopos más comunes incluyen el carbono-12, carbono-14, hidrógeno-2 (deuterio) y uranio-238. Cada uno de estos isótopos tiene propiedades únicas que los hacen útiles en diversas aplicaciones científicas y tecnológicas.
¿Qué diferencia hay entre isótopos estables e inestables?
Los isótopos estables no sufren descomposición radiactiva, mientras que los isótopos inestables, o radiactivos, lo hacen, liberando energía en forma de radiación. Esta diferencia es crucial en su aplicación en campos como la medicina y la investigación científica.
¿Cómo se forman los isótopos?
Los isótopos se forman de manera natural y artificial. En la naturaleza, algunos elementos tienen varios isótopos debido a la estabilidad de sus núcleos. También pueden ser creados en laboratorios mediante reacciones nucleares, donde se bombardean átomos con partículas subatómicas.
¿Por qué se utilizan isótopos en la datación?
Los isótopos radiactivos, como el carbono-14, se utilizan en la datación radiométrica para determinar la edad de materiales orgánicos. Este método es fundamental en arqueología y paleontología, ya que permite a los científicos establecer cronologías de eventos históricos y evolutivos.
¿Qué papel juegan los isótopos en el cambio climático?
Los isótopos estables en gases de efecto invernadero ayudan a los científicos a identificar las fuentes y procesos que contribuyen al cambio climático. Esto es esencial para desarrollar estrategias efectivas de mitigación y comprender cómo los seres humanos afectan el clima de la Tierra.