Las proteínas son macromoléculas esenciales para la vida, desempeñando roles cruciales en procesos biológicos como la catalización de reacciones, la regulación del metabolismo y la respuesta inmunitaria. Uno de los conceptos fundamentales para entender el comportamiento y la funcionalidad de las proteínas es el punto isoeléctrico (pI). Este parámetro no solo influye en la solubilidad de las proteínas, sino que también afecta su estabilidad y su interacción con otras biomoléculas. En este artículo, exploraremos la importancia del punto isoeléctrico de las proteínas y cómo este conocimiento es clave para comprender su función y estabilidad. Desde los principios básicos del pI hasta sus aplicaciones prácticas en biotecnología y medicina, aquí encontrarás una guía completa que desentraña la relevancia de este concepto en el mundo de la bioquímica.
¿Qué es el Punto Isoeléctrico?
El punto isoeléctrico de una proteína es el pH en el cual la carga neta de la proteína es cero. Esto significa que, en este punto, las cargas positivas y negativas se equilibran, lo que puede afectar significativamente cómo se comporta la proteína en diferentes entornos. Para entender mejor este concepto, es útil desglosarlo en varios componentes clave.
Definición y Cálculo del Punto Isoeléctrico
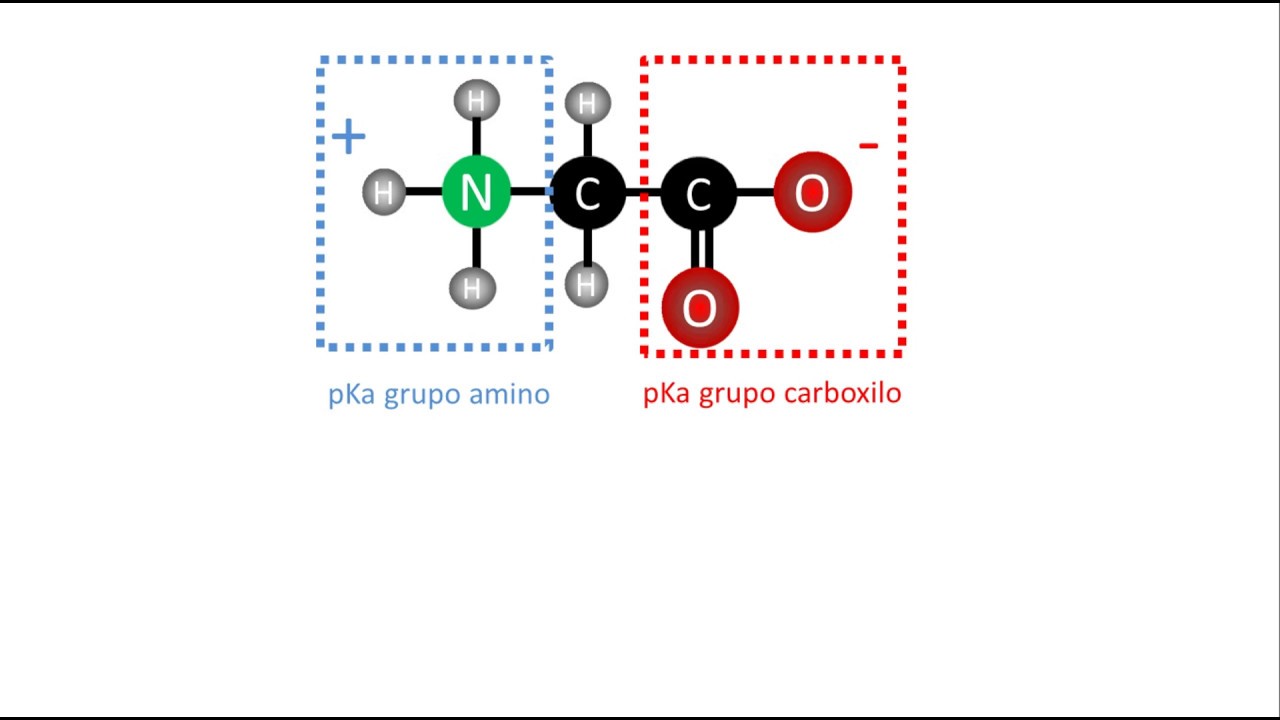
El punto isoeléctrico se determina por la composición de aminoácidos de la proteína y su entorno químico. Cada aminoácido tiene un grupo amino y un grupo carboxilo que pueden ionizarse, lo que significa que pueden ganar o perder protones dependiendo del pH del entorno. El pI se calcula generalmente usando la fórmula que promedia los pKa de los grupos ionizables que contribuyen a la carga de la proteína en ese rango de pH. En proteínas con múltiples grupos ionizables, el cálculo puede ser más complejo, pero sigue siendo fundamental para predecir su comportamiento.
Por ejemplo, si una proteína tiene un pKa de 2.1 para su grupo carboxilo y un pKa de 9.1 para su grupo amino, el pI se encontrará entre estos valores. En este caso, la proteína tendrá una carga neta de cero en el pH medio entre esos dos pKa.
Importancia del Punto Isoeléctrico en la Solubilidad
La solubilidad de una proteína en solución acuosa está íntimamente relacionada con su punto isoeléctrico. Cuando el pH de la solución se aleja del pI, la proteína tiende a cargar y, por lo tanto, se repelen entre sí, lo que puede aumentar su solubilidad. Por otro lado, cuando el pH se aproxima al pI, las proteínas pueden precipitarse, ya que la repulsión entre las moléculas se reduce. Este fenómeno es crucial en procesos como la purificación de proteínas, donde se manipula el pH para favorecer o desalentar la precipitación.
La Relación entre el Punto Isoeléctrico y la Estabilidad de las Proteínas
La estabilidad de las proteínas no solo depende de su estructura tridimensional, sino también del entorno en el que se encuentran. El punto isoeléctrico juega un papel importante en la estabilidad de las proteínas, afectando su conformación y la interacción con otros componentes celulares.
Desnaturalización y el Efecto del pH
La desnaturalización es un proceso en el que una proteína pierde su estructura nativa, lo que puede resultar en la pérdida de su función. El pH del entorno puede inducir desnaturalización, especialmente si se aleja del pI. En condiciones donde el pH es demasiado alto o bajo, las interacciones no covalentes que mantienen la estructura de la proteína pueden romperse, llevando a un colapso estructural. Por ejemplo, muchas enzimas son extremadamente sensibles a cambios en el pH, y operar fuera de su rango óptimo puede inactivar su función catalítica.
Interacciones Proteína-Proteína y Punto Isoeléctrico
Las interacciones entre proteínas son esenciales para la formación de complejos funcionales, y el punto isoeléctrico puede influir en estas interacciones. Las proteínas con cargas opuestas tienden a unirse, mientras que las que tienen cargas similares se repelen. Por lo tanto, en un sistema donde las proteínas interactúan, el pH del entorno puede determinar la formación de complejos o la estabilidad de estructuras supramoleculares. Por ejemplo, en la formación de agregados proteicos, el ajuste del pH puede ser una estrategia utilizada para controlar la solubilidad y la estabilidad de la mezcla.
Aplicaciones Prácticas del Punto Isoeléctrico
El conocimiento del punto isoeléctrico de las proteínas tiene numerosas aplicaciones prácticas, desde la investigación básica hasta la biotecnología y la medicina. Comprender cómo manipular el pI de las proteínas puede abrir nuevas vías para la innovación en diversos campos.
Purificación de Proteínas
La purificación de proteínas es un proceso crítico en biotecnología y farmacología. Los métodos como la electroforesis y la cromatografía de intercambio iónico se basan en el principio del punto isoeléctrico. En la cromatografía de intercambio iónico, las proteínas se separan en función de su carga en un rango de pH específico. Ajustar el pH de la solución puede facilitar la elución de proteínas específicas, lo que permite una purificación más eficiente.
Desarrollo de Fármacos
En el desarrollo de fármacos, la estabilidad y solubilidad de las proteínas terapéuticas son cruciales. Conocer el pI de una proteína terapéutica puede ayudar a los científicos a diseñar formulaciones que maximicen su eficacia y minimicen la degradación. Además, al ajustar el pH de las formulaciones, se pueden optimizar las interacciones entre el fármaco y su objetivo biológico, mejorando así la eficacia del tratamiento.
Factores que Afectan el Punto Isoeléctrico
El punto isoeléctrico no es un valor fijo; puede verse afectado por diversos factores. Conocer estos factores es esencial para manipular y entender el comportamiento de las proteínas en diferentes contextos.
Composición de Aminoácidos
La composición de aminoácidos de una proteína es uno de los factores más influyentes en su pI. Los aminoácidos con cadenas laterales ionizables, como el ácido aspártico, el ácido glutámico, la lisina y la arginina, contribuyen significativamente a la carga neta de la proteína. Por lo tanto, la variación en la secuencia de aminoácidos puede resultar en diferentes puntos isoeléctricos incluso para proteínas con funciones similares.
Modificaciones Post-Traduccionales
Las modificaciones post-traduccionales, como la fosforilación o la glicosilación, también pueden alterar el pI de una proteína. Estas modificaciones pueden añadir grupos cargados a la proteína, cambiando su comportamiento en diferentes condiciones de pH. Por ejemplo, la fosforilación de residuos de serina o treonina puede aumentar la carga negativa de una proteína, afectando su pI y, por ende, su solubilidad y estabilidad.
Perspectivas Futuras en el Estudio del Punto Isoeléctrico
A medida que avanza la investigación en biología molecular y biotecnología, el estudio del punto isoeléctrico de las proteínas seguirá siendo un área de interés. Nuevas técnicas de análisis y modelado computacional permitirán a los científicos predecir con mayor precisión el pI de proteínas complejas y su comportamiento en diversas condiciones.
Innovaciones en Biotecnología
La biotecnología está en constante evolución, y el entendimiento del punto isoeléctrico de las proteínas será clave para desarrollar nuevas terapias y productos. La ingeniería de proteínas para optimizar su pI puede resultar en proteínas más estables y efectivas para aplicaciones terapéuticas. Además, el diseño de nuevos métodos de purificación y análisis basados en el pI puede mejorar la producción de proteínas terapéuticas.
Estudios sobre Enfermedades y el Punto Isoeléctrico
Las enfermedades a menudo se asocian con alteraciones en la estructura y función de las proteínas. Investigar el punto isoeléctrico de proteínas implicadas en enfermedades puede proporcionar información valiosa sobre su patología y abrir nuevas vías para tratamientos. Por ejemplo, en el caso de enfermedades neurodegenerativas, donde las proteínas tienden a agregarse, comprender el pI puede ser crucial para desarrollar estrategias que eviten la agregación y mantengan la función proteica.
¿Cómo se mide el punto isoeléctrico de una proteína?
El punto isoeléctrico de una proteína se puede medir mediante técnicas de electroforesis en gel, donde se observa el pH en el que la proteína no se mueve, indicando que su carga neta es cero. También se pueden utilizar métodos de titulación ácido-base para determinar los valores de pKa y, en consecuencia, calcular el pI.
¿Por qué es importante el pI en la formulación de medicamentos?
El pI es crucial en la formulación de medicamentos porque afecta la solubilidad y estabilidad de las proteínas terapéuticas. Ajustar el pH de una formulación puede mejorar la eficacia del fármaco y minimizar la degradación, asegurando que el medicamento sea efectivo al llegar al paciente.
¿El pI de una proteína cambia en diferentes condiciones fisiológicas?
Sí, el pI de una proteína puede variar en diferentes condiciones fisiológicas debido a cambios en el pH del entorno, la concentración de iones y la presencia de otras moléculas que pueden influir en la carga neta de la proteína. Esto es especialmente relevante en entornos como el interior de las células o en fluidos biológicos.
¿Qué papel juega el pI en la purificación de proteínas?
El pI es fundamental en la purificación de proteínas, ya que permite la separación de proteínas en función de su carga. Técnicas como la cromatografía de intercambio iónico se basan en el principio de que las proteínas se comportan de manera diferente en función del pH, facilitando su purificación mediante el ajuste del pH de la solución.
¿Cómo afecta el pI a la actividad enzimática?
La actividad enzimática puede verse afectada por el pI, ya que muchas enzimas tienen un rango óptimo de pH en el que funcionan mejor. Si el pH se aleja del pI de la enzima, puede haber cambios en la carga de los grupos activos, lo que podría afectar su capacidad para unirse a los sustratos y catalizar reacciones.
¿Qué implicaciones tiene el pI en el estudio de enfermedades?
El pI puede proporcionar información valiosa en el estudio de enfermedades, ya que las alteraciones en el pI de proteínas pueden estar asociadas con cambios en su función y estabilidad. Comprender estas variaciones puede ayudar a desarrollar tratamientos más específicos y eficaces para diversas condiciones patológicas.
¿Es posible modificar el pI de una proteína?
Sí, es posible modificar el pI de una proteína a través de técnicas de ingeniería de proteínas, donde se introducen mutaciones en la secuencia de aminoácidos para alterar los grupos ionizables. Estas modificaciones pueden mejorar la estabilidad, solubilidad y funcionalidad de la proteína en aplicaciones biotecnológicas y terapéuticas.