La tabla periódica es uno de los pilares fundamentales de la química, una herramienta que nos permite entender la naturaleza de los elementos que componen el universo. En ella, cada elemento se presenta con su número atómico y su masa atómica, dos conceptos que son cruciales para comprender sus propiedades y comportamientos. Pero, ¿qué significan realmente estos términos? ¿Cómo se relacionan entre sí y con los elementos que forman todo a nuestro alrededor? En este artículo, desglosaremos la tabla periódica, enfocándonos en los números atómicos y las masas atómicas, explicando su importancia y cómo se utilizan en la práctica. A lo largo de este recorrido, exploraremos la historia detrás de la tabla, la organización de los elementos, y responderemos a preguntas comunes para que tengas una comprensión completa de este fascinante tema.
¿Qué es la Tabla Periódica?
La tabla periódica es una representación tabular de los elementos químicos, organizada según sus propiedades y características. Fue desarrollada en el siglo XIX por el químico ruso Dmitri Mendeléyev, quien agrupó los elementos en función de su masa atómica y propiedades químicas similares. Hoy en día, la tabla se basa principalmente en el número atómico, que es la cantidad de protones en el núcleo de un átomo de un elemento.
Organización de los Elementos
Los elementos en la tabla periódica están organizados en filas horizontales llamadas periodos y columnas verticales llamadas grupos. Cada grupo contiene elementos que comparten características químicas similares. Por ejemplo, los elementos del grupo 1, conocidos como metales alcalinos, son altamente reactivos y tienen un solo electrón en su capa más externa.
La disposición de los elementos no solo facilita la identificación de sus propiedades, sino que también permite predecir comportamientos químicos. Por ejemplo, los elementos en el mismo grupo tienden a reaccionar de manera similar en reacciones químicas. Esto se debe a que tienen una configuración electrónica comparable, lo que influye en su reactividad.
Importancia de la Tabla Periódica
La tabla periódica es más que un simple gráfico; es una herramienta esencial para los químicos y científicos de todas las disciplinas. Proporciona un marco para entender las relaciones entre los elementos y cómo se combinan para formar compuestos. Además, es fundamental en la educación científica, ayudando a los estudiantes a visualizar y comprender conceptos complejos de la química.
Número Atómico: Definición y Significado
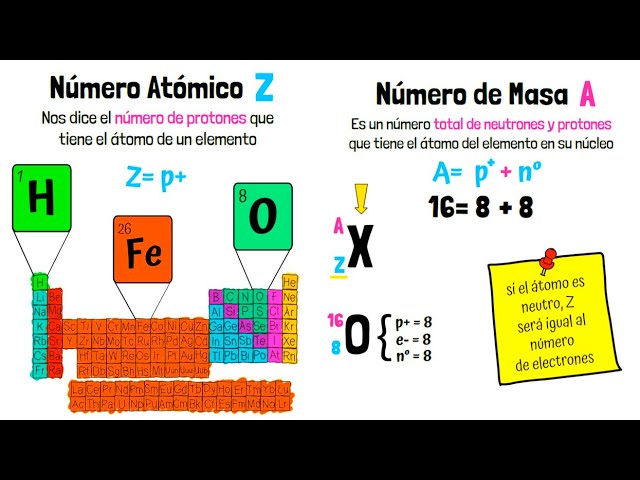
El número atómico es un valor único para cada elemento que indica la cantidad de protones en el núcleo de sus átomos. Este número es crucial porque determina la identidad del elemento y sus propiedades químicas. Por ejemplo, el hidrógeno tiene un número atómico de 1, lo que significa que tiene un solo protón, mientras que el oxígeno, con un número atómico de 8, tiene ocho protones.
Relación con la Carga Eléctrica
El número atómico también está relacionado con la carga eléctrica del átomo. En un átomo neutro, el número de electrones es igual al número de protones, lo que significa que la carga total es cero. Sin embargo, si un átomo pierde o gana electrones, se convierte en un ion, lo que afecta su comportamiento químico. Por ejemplo, el sodio (Na) tiene un número atómico de 11, y al perder un electrón se convierte en un ion Na+, que tiene propiedades muy diferentes al sodio neutro.
Ejemplos Prácticos
Algunos ejemplos de números atómicos incluyen:
- Hidrógeno (H) – Número atómico 1
- Carbono (C) – Número atómico 6
- Hierro (Fe) – Número atómico 26
- Uranio (U) – Número atómico 92
Cada uno de estos elementos tiene características únicas que son el resultado directo de su número atómico, afectando su reactividad, estado físico y capacidad para formar compuestos.
Masas Atómicas: ¿Qué Son y Cómo Se Calculan?
La masa atómica es el promedio ponderado de las masas de todos los isótopos de un elemento, teniendo en cuenta su abundancia natural. Se mide en unidades de masa atómica (uma) y es un dato esencial para comprender cómo interactúan los elementos en reacciones químicas. Por ejemplo, la masa atómica del carbono es aproximadamente 12.01 uma, lo que refleja la presencia de isótopos como el carbono-12 y el carbono-14 en la naturaleza.
Isótopos y su Influencia en la Masa Atómica
Los isótopos son átomos del mismo elemento que tienen el mismo número de protones pero diferente número de neutrones. Esto significa que, aunque comparten propiedades químicas, su masa puede variar. Por ejemplo, el hidrógeno tiene tres isótopos: el hidrógeno común (1 protón, 0 neutrones), el deuterio (1 protón, 1 neutrón) y el tritio (1 protón, 2 neutrones). La masa atómica promedio del hidrógeno es influenciada por la abundancia de estos isótopos en la naturaleza.
Importancia en la Química
La masa atómica es fundamental en las reacciones químicas, ya que se utiliza para calcular las proporciones en las que los elementos reaccionan. La ley de conservación de la masa establece que en una reacción química, la masa total de los reactivos es igual a la masa total de los productos. Por lo tanto, conocer la masa atómica de los elementos permite a los químicos equilibrar ecuaciones y predecir productos de reacciones.
La Tabla Periódica Moderna y Sus Avances
Desde la creación de la tabla periódica por Mendeléyev, ha habido numerosos avances en la comprensión de los elementos y su organización. La tabla moderna incluye elementos sintéticos, que son creados en laboratorios y no se encuentran en la naturaleza. Estos elementos, como el elemento 118 (oganesson), se han añadido a la tabla y han ampliado nuestra comprensión de la química.
Elementos Sintéticos y su Importancia
Los elementos sintéticos son aquellos que no se encuentran de forma natural en la Tierra y son producidos mediante reacciones nucleares. Aunque muchos de estos elementos son inestables y tienen vidas medias cortas, su estudio es crucial para comprender la física nuclear y la estructura atómica. Además, algunos de estos elementos tienen aplicaciones prácticas en medicina, como el uso de isótopos radiactivos en la terapia del cáncer.
Futuro de la Tabla Periódica
A medida que la ciencia avanza, es probable que se descubran nuevos elementos y se desarrollen nuevas teorías sobre la organización de la materia. La tabla periódica seguirá siendo un símbolo de la química, uniendo a científicos de todo el mundo en la búsqueda de entender la naturaleza y sus componentes fundamentales.
¿Qué es el número atómico y por qué es importante?
El número atómico es el número de protones en el núcleo de un átomo y determina la identidad del elemento. Es crucial porque define las propiedades químicas y físicas del elemento, así como su posición en la tabla periódica. Por ejemplo, el hidrógeno tiene un número atómico de 1, lo que lo convierte en el elemento más ligero y simple.
¿Cómo se calcula la masa atómica de un elemento?
La masa atómica se calcula como el promedio ponderado de las masas de todos los isótopos de un elemento, considerando su abundancia en la naturaleza. Este cálculo tiene en cuenta tanto la masa de los protones y neutrones en el núcleo, como la cantidad de cada isótopo presente.
¿Por qué algunos elementos tienen masas atómicas con decimales?
Las masas atómicas a menudo tienen decimales porque son promedios ponderados de las masas de isótopos que existen en diferentes proporciones en la naturaleza. Por ejemplo, el carbono tiene una masa atómica de aproximadamente 12.01 uma debido a la mezcla de sus isótopos, el carbono-12 y el carbono-14, que tienen masas ligeramente diferentes.
¿Qué son los isótopos y cómo afectan la masa atómica?
Los isótopos son átomos del mismo elemento que tienen el mismo número de protones pero diferente número de neutrones, lo que les da diferentes masas. La presencia de estos isótopos en distintas proporciones afecta la masa atómica promedio del elemento. Por ejemplo, el cloro tiene dos isótopos principales, el cloro-35 y el cloro-37, que contribuyen a su masa atómica promedio.
¿Cómo se relacionan el número atómico y la masa atómica?
El número atómico determina la identidad del elemento y su posición en la tabla periódica, mientras que la masa atómica refleja la masa promedio de los isótopos del elemento. Aunque están relacionados, son conceptos diferentes; el número atómico es un entero, mientras que la masa atómica puede ser un valor decimal debido a la presencia de isótopos.
¿Qué avances recientes ha habido en la tabla periódica?
Recientemente, se han añadido elementos sintéticos a la tabla periódica, que son creados en laboratorios y no se encuentran en la naturaleza. Estos avances han ampliado nuestra comprensión de la química y la física nuclear. Además, se están explorando nuevas teorías sobre la organización de los elementos y sus propiedades, lo que sugiere que el estudio de la tabla periódica está lejos de haber terminado.