El agua es uno de los compuestos más esenciales en la Tierra, pero ¿qué es lo que realmente la convierte en un disolvente tan eficaz? La respuesta radica en sus propiedades únicas a nivel molecular. Este líquido, que constituye aproximadamente el 71% de la superficie terrestre y es vital para todas las formas de vida, tiene la capacidad de disolver más sustancias que cualquier otro líquido conocido. En este artículo, exploraremos a fondo la característica clave que hace del agua un potente disolvente, así como las implicaciones de esta propiedad en diferentes contextos, desde la biología hasta la química y la industria. A medida que avancemos, descubrirás cómo esta capacidad del agua influye en procesos cotidianos y en aplicaciones científicas. Prepárate para adentrarte en el fascinante mundo del agua y su increíble poder disolvente.
La Estructura Molecular del Agua
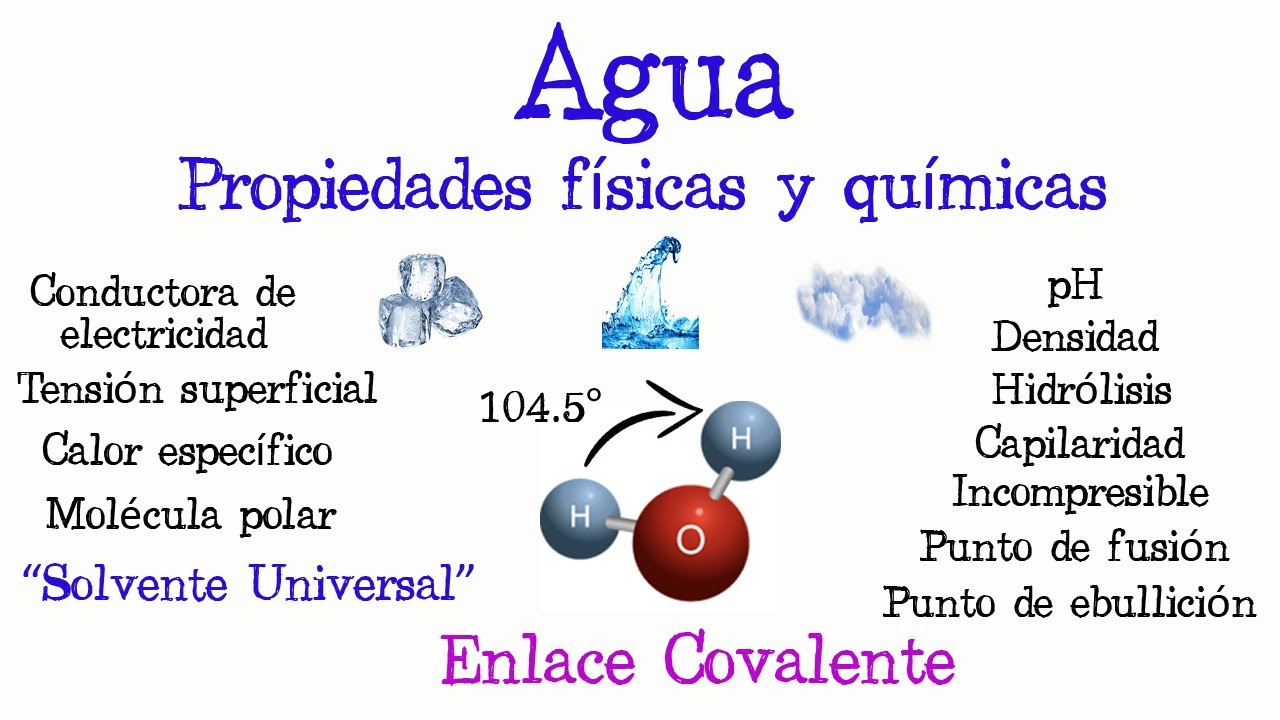
Para entender por qué el agua es un disolvente tan efectivo, primero debemos explorar su estructura molecular. El agua (H₂O) está compuesta por dos átomos de hidrógeno y uno de oxígeno, formando un ángulo de aproximadamente 104.5 grados. Esta geometría molecular es fundamental para sus propiedades únicas.
Polaridad del Agua
Una de las características más destacadas del agua es su polaridad. La polaridad se refiere a la distribución desigual de electrones entre los átomos que componen una molécula. En el caso del agua, el oxígeno es más electronegativo que el hidrógeno, lo que significa que atrae más electrones hacia sí mismo. Como resultado, el oxígeno adquiere una carga parcial negativa, mientras que los hidrógenos tienen cargas parciales positivas. Esta diferencia de carga permite que las moléculas de agua interactúen fácilmente con otras sustancias.
Cuando el agua se encuentra con una sustancia, sus moléculas polares pueden rodear y separar las moléculas de esa sustancia, facilitando su disolución. Por ejemplo, cuando agregas sal (NaCl) al agua, las moléculas de agua rodean los iones de sodio y cloruro, separándolos y permitiendo que se distribuyan uniformemente en la solución.
Puentes de Hidrógeno
Otra propiedad clave del agua que contribuye a su capacidad como disolvente es la formación de puentes de hidrógeno. Estos enlaces son interacciones débiles pero significativas que se producen entre el hidrógeno de una molécula de agua y el oxígeno de otra. Esta red de puentes de hidrógeno no solo le confiere al agua su alta cohesión y tensión superficial, sino que también facilita su interacción con otras moléculas.
Cuando una sustancia se disuelve en agua, los puentes de hidrógeno permiten que las moléculas de agua se organicen alrededor de los solutos, ayudando a estabilizarlos en la solución. Esto es especialmente importante en procesos biológicos, donde las reacciones químicas a menudo dependen de la solubilidad de los compuestos en el agua.
El Agua y su Relación con Solutos Iónicos y Moleculares
El agua es capaz de disolver una amplia variedad de sustancias, pero su eficacia varía dependiendo de la naturaleza del soluto. Comprender cómo interactúa el agua con diferentes tipos de solutos es esencial para apreciar su papel como disolvente.
Solutos Iónicos
Los solutos iónicos, como la sal común, se disuelven en agua debido a la polaridad de las moléculas de agua. Cuando la sal se introduce en el agua, los iones de sodio (Na⁺) y cloruro (Cl⁻) son atraídos por las cargas opuestas de las moléculas de agua. Los iones positivos son rodeados por el extremo negativo (oxígeno) de las moléculas de agua, mientras que los iones negativos son rodeados por el extremo positivo (hidrógeno). Este proceso de disolución permite que los iones se distribuyan uniformemente en la solución, facilitando su interacción en reacciones químicas.
Solutos Moleculares
Por otro lado, los solutos moleculares, como el azúcar, también se disuelven en agua, aunque el mecanismo es un poco diferente. Las moléculas de azúcar, que son polares, forman interacciones con las moléculas de agua a través de enlaces de hidrógeno. Este proceso permite que las moléculas de azúcar se separen y se dispersen en el agua. Es interesante notar que no todos los solutos moleculares se disuelven en agua; la solubilidad depende de la polaridad y la estructura de la molécula. Por ejemplo, los compuestos no polares, como los aceites, no se disuelven en agua, lo que ilustra la famosa regla de «lo similar disuelve a lo similar».
El Papel del Agua en Procesos Biológicos
El agua no solo es un disolvente eficaz en el laboratorio, sino que también juega un papel crucial en los procesos biológicos. La mayoría de las reacciones químicas que ocurren en los organismos vivos se llevan a cabo en un medio acuoso, lo que resalta la importancia del agua en la biología.
Transporte de Nutrientes y Desechos
En los organismos multicelulares, el agua actúa como un medio de transporte esencial. Por ejemplo, en los seres humanos, el sistema circulatorio utiliza la sangre, que es principalmente agua, para transportar nutrientes, hormonas y oxígeno a las células, mientras que también elimina los desechos metabólicos. Este proceso de disolución y transporte es fundamental para mantener la homeostasis y la salud celular.
Reacciones Químicas en el Cuerpo
Además, el agua es un reactante en muchas reacciones químicas en el cuerpo. La hidrólisis, un proceso en el cual las moléculas de agua se utilizan para romper enlaces químicos, es esencial en la digestión de alimentos. Por ejemplo, las proteínas se descomponen en aminoácidos a través de reacciones de hidrólisis, permitiendo que el cuerpo absorba y utilice estos nutrientes.
Aplicaciones Industriales del Agua como Disolvente
El agua también tiene una amplia gama de aplicaciones industriales gracias a su capacidad como disolvente. Desde la fabricación de productos químicos hasta la producción de alimentos, el agua desempeña un papel central en muchos procesos.
Producción Química
En la industria química, el agua se utiliza como disolvente en numerosas reacciones. Su capacidad para disolver reactivos facilita la mezcla y la reacción de compuestos, lo que resulta en la producción de una variedad de productos, desde plásticos hasta productos farmacéuticos. La selección del agua como disolvente se debe a su disponibilidad, bajo costo y capacidad para disolver una amplia gama de sustancias.
Industria Alimentaria
En la industria alimentaria, el agua se utiliza no solo para disolver ingredientes, sino también para procesos como la cocción y la pasteurización. Al disolver azúcares y sales en agua, se pueden crear soluciones que mejoran el sabor y la conservación de los alimentos. Además, el agua caliente se utiliza para extraer sabores y nutrientes de los ingredientes, lo que es fundamental en la preparación de alimentos como sopas y salsas.
Impacto del Agua en el Medio Ambiente
La capacidad del agua para disolver sustancias también tiene implicaciones importantes para el medio ambiente. Aunque el agua es un disolvente esencial para la vida, su habilidad para disolver contaminantes plantea desafíos significativos.
Contaminación del Agua
Los contaminantes, como metales pesados, productos químicos y pesticidas, pueden disolverse en el agua, afectando la calidad del agua y la salud de los ecosistemas acuáticos. Este fenómeno resalta la importancia de proteger las fuentes de agua y controlar la contaminación para preservar la vida acuática y la salud humana.
Reciclaje de Agua
Por otro lado, la capacidad del agua para disolver sustancias también se aprovecha en el tratamiento y reciclaje de agua. Las plantas de tratamiento utilizan procesos químicos y biológicos para eliminar contaminantes y devolver el agua tratada a los ecosistemas o a los sistemas de suministro. Este proceso es crucial para garantizar que el agua potable sea segura y accesible.
¿Por qué el agua es considerada el «disolvente universal»?
El agua es conocida como el «disolvente universal» debido a su capacidad para disolver una amplia variedad de sustancias, incluyendo sales, azúcares y gases. Su polaridad y la capacidad de formar puentes de hidrógeno le permiten interactuar eficazmente con diferentes tipos de compuestos, facilitando reacciones químicas y procesos biológicos.
¿Todos los líquidos son disolventes como el agua?
No, no todos los líquidos son disolventes como el agua. La capacidad de un líquido para disolver una sustancia depende de la polaridad de ambos. Por ejemplo, los líquidos no polares, como los aceites, no pueden disolver sustancias polares como el agua. La regla general es que «lo similar disuelve a lo similar».
¿Qué sucede cuando se mezcla agua con aceite?
Cuando se mezcla agua con aceite, estos no se disuelven entre sí. Esto se debe a que el agua es polar y el aceite es no polar, lo que resulta en una separación. El aceite flota en la superficie del agua, formando una capa distinta, lo que ilustra cómo diferentes propiedades químicas pueden influir en la solubilidad.
¿Cómo afecta la temperatura al poder disolvente del agua?
La temperatura puede afectar el poder disolvente del agua. En general, a medida que la temperatura aumenta, la solubilidad de muchos sólidos en agua también aumenta. Sin embargo, la solubilidad de algunos gases disminuye con el aumento de temperatura. Esto significa que la temperatura juega un papel crucial en los procesos de disolución y reacciones químicas.
¿El agua puede disolver metales?
El agua no disuelve metales en su forma elemental, pero puede disolver ciertos iones metálicos cuando están en forma de sales. Por ejemplo, el cloruro de sodio (sal común) se disuelve en agua, liberando iones de sodio y cloruro. Sin embargo, metales como el hierro o el cobre no se disuelven en agua pura.
¿Qué papel juega el agua en la agricultura?
El agua es fundamental en la agricultura, no solo para el riego de cultivos, sino también como medio para disolver nutrientes del suelo y transportarlos a las plantas. Sin agua, las plantas no pueden absorber los minerales y nutrientes necesarios para su crecimiento. Por lo tanto, la gestión adecuada del agua es crucial para la producción agrícola sostenible.