Las reacciones químicas son procesos fundamentales que no solo transforman las sustancias, sino que también implican un intercambio constante de energía. Desde la fotosíntesis en las plantas hasta la combustión de combustibles fósiles, el estudio del intercambio de energía en reacciones químicas es esencial para comprender cómo funciona el mundo a nuestro alrededor. En este artículo, exploraremos las distintas formas en que la energía se intercambia durante las reacciones químicas, los tipos de reacciones involucradas, así como su importancia en diferentes campos, desde la biología hasta la ingeniería. Te invitamos a sumergirte en este fascinante tema que es clave para múltiples disciplinas científicas.
¿Qué es el Intercambio de Energía en Reacciones Químicas?
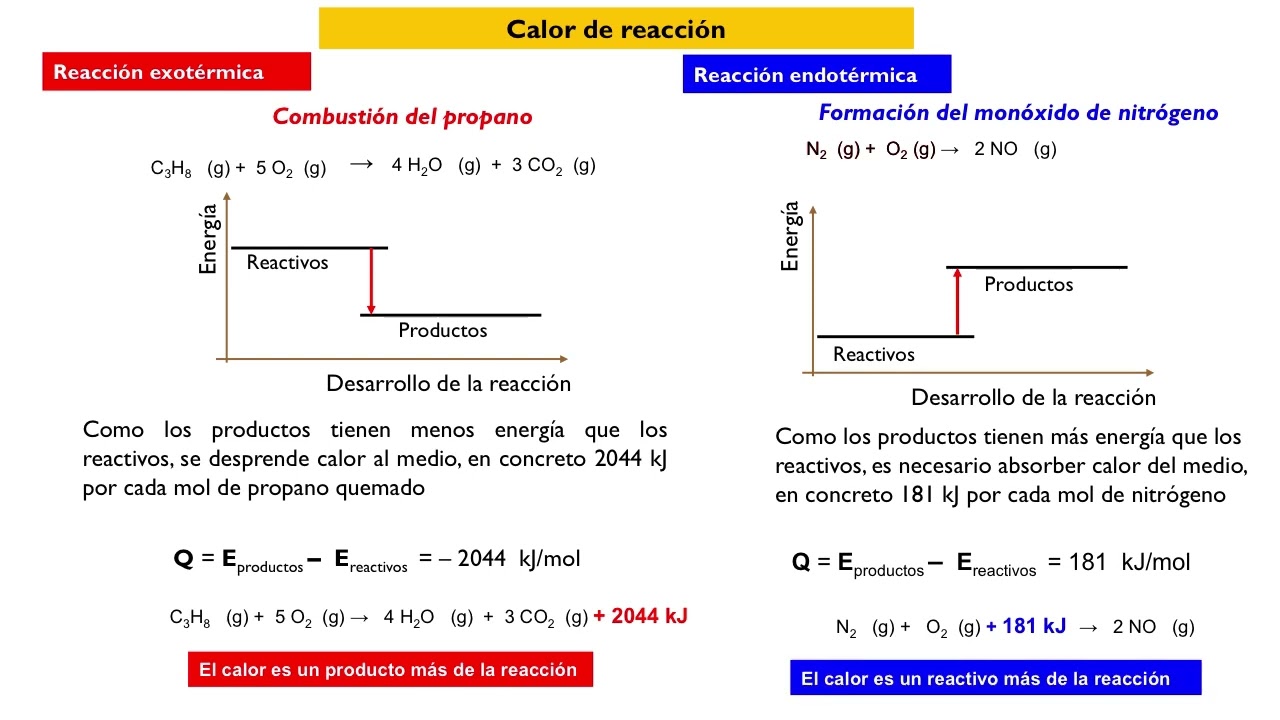
El intercambio de energía en reacciones químicas se refiere a cómo se libera o absorbe energía durante el proceso de transformación de reactivos en productos. Este fenómeno está íntimamente relacionado con los cambios en la energía interna de los sistemas químicos y puede manifestarse de varias formas. A continuación, se describen las dos categorías principales de reacciones en términos de energía: exotérmicas y endotérmicas.
Reacciones Exotérmicas
Las reacciones exotérmicas son aquellas que liberan energía al entorno. Este tipo de reacciones ocurre cuando la energía necesaria para romper los enlaces en los reactivos es menor que la energía liberada al formar nuevos enlaces en los productos. Un ejemplo clásico es la combustión de hidrocarburos, como el metano (CH4), que al reaccionar con oxígeno (O2) libera una gran cantidad de calor y luz.
Cuando se queman 1 mol de metano, se liberan aproximadamente 890 kJ de energía. Este proceso no solo calienta el entorno, sino que también es utilizado en motores de automóviles y sistemas de calefacción. Las reacciones exotérmicas son esenciales en muchas aplicaciones industriales y cotidianas, destacándose por su capacidad para proporcionar energía de manera eficiente.
Reacciones Endotérmicas
Por otro lado, las reacciones endotérmicas son aquellas que requieren un aporte de energía del entorno para llevarse a cabo. En este caso, la energía absorbida para romper los enlaces en los reactivos es mayor que la energía liberada al formar los productos. Un ejemplo común de reacción endotérmica es la fotosíntesis, donde las plantas absorben luz solar para convertir dióxido de carbono y agua en glucosa y oxígeno.
Este proceso no solo es vital para la vida en la Tierra, sino que también es un claro ejemplo de cómo la energía solar se almacena en forma de energía química. La fotosíntesis es crucial no solo para las plantas, sino también para todos los organismos que dependen de ellas como fuente de alimento y oxígeno.
La Ley de Conservación de la Energía en Reacciones Químicas
Una de las bases fundamentales del intercambio de energía en reacciones químicas es la ley de conservación de la energía, que establece que la energía no se crea ni se destruye, solo se transforma. En el contexto de las reacciones químicas, esto significa que la energía total de los reactivos debe ser igual a la energía total de los productos más la energía intercambiada con el entorno. Esta ley es crucial para entender cómo se llevan a cabo las reacciones químicas y su impacto en los sistemas biológicos y físicos.
Ejemplos de Conservación de Energía
Imaginemos una reacción de neutralización entre un ácido y una base. Durante esta reacción, se produce agua y una sal, y se libera energía en forma de calor. Aunque la energía se transforma y se libera, la cantidad total de energía en el sistema permanece constante. Este principio se aplica a todas las reacciones químicas y es esencial para el diseño de procesos químicos eficientes en la industria.
Otro ejemplo puede encontrarse en la reacción de descomposición del peróxido de hidrógeno (H2O2), que se descompone en agua y oxígeno. Este proceso, que puede ser catalizado por la enzima catalasa, también implica un intercambio de energía, donde parte de la energía almacenada en los enlaces del peróxido de hidrógeno se libera como energía térmica y luz.
Factores que Afectan el Intercambio de Energía
Varios factores pueden influir en el intercambio de energía durante las reacciones químicas. Estos incluyen la temperatura, la presión, la concentración de reactivos y la presencia de catalizadores. Cada uno de estos factores puede alterar la energía de activación necesaria para que la reacción ocurra, así como la cantidad de energía liberada o absorbida.
Temperatura
La temperatura es uno de los factores más significativos que afectan las reacciones químicas. A medida que aumenta la temperatura, las moléculas de los reactivos se mueven más rápido, lo que incrementa la frecuencia y la energía de las colisiones entre ellas. Esto puede resultar en un aumento de la velocidad de la reacción y, por ende, en un mayor intercambio de energía. Por ejemplo, la mayoría de las reacciones químicas se llevan a cabo más rápidamente a temperaturas elevadas, lo que puede ser aprovechado en procesos industriales.
Presión
En el caso de las reacciones que involucran gases, la presión también puede tener un efecto considerable. Al aumentar la presión, se incrementa la concentración de los reactivos gaseosos, lo que puede favorecer la formación de productos. Este principio se utiliza en la producción de amoníaco a través del proceso Haber-Bosch, donde la alta presión y temperatura favorecen la reacción entre el nitrógeno y el hidrógeno, resultando en un mayor rendimiento.
Catalizadores
Los catalizadores son sustancias que aumentan la velocidad de una reacción química sin ser consumidos en el proceso. Al reducir la energía de activación requerida para que la reacción ocurra, los catalizadores permiten que se produzca un intercambio de energía más eficiente. Un ejemplo cotidiano es el uso de catalizadores en automóviles, que ayudan a convertir gases nocivos en productos menos dañinos, optimizando así el intercambio de energía durante la combustión.
Aplicaciones del Intercambio de Energía en Reacciones Químicas
El estudio del intercambio de energía en reacciones químicas tiene numerosas aplicaciones en distintos campos. Desde la medicina hasta la ingeniería, la comprensión de cómo se produce y se utiliza la energía es esencial para el desarrollo de nuevas tecnologías y procesos. A continuación, exploraremos algunas de las aplicaciones más relevantes.
En la Industria Química
La industria química se basa en gran medida en el control de reacciones químicas y el intercambio de energía. Por ejemplo, en la producción de plásticos, se utilizan reacciones exotérmicas para sintetizar polímeros a partir de monómeros. El manejo eficiente de la energía en estas reacciones es crucial para maximizar el rendimiento y reducir costos.
Además, el diseño de reactores químicos está optimizado para garantizar que las condiciones de temperatura y presión sean las adecuadas para favorecer el intercambio de energía deseado. Esto no solo mejora la eficiencia del proceso, sino que también minimiza el impacto ambiental.
En la Biología
En el campo de la biología, el intercambio de energía es fundamental para los procesos metabólicos. Las células utilizan reacciones químicas para obtener energía de los alimentos y convertirla en formas utilizables, como el ATP (adenosín trifosfato). Entender cómo se producen y se utilizan estas reacciones es vital para el desarrollo de tratamientos médicos y terapias.
Por ejemplo, el estudio del metabolismo celular ha llevado a avances en la medicina, incluyendo tratamientos para enfermedades metabólicas que afectan la capacidad del cuerpo para procesar energía. La investigación en este ámbito continúa siendo un área activa de estudio en biomedicina.
Intercambio de Energía y Sustentabilidad
El intercambio de energía en reacciones químicas también juega un papel crucial en la búsqueda de soluciones sostenibles. Con el aumento de la preocupación por el cambio climático y la necesidad de fuentes de energía renovable, comprender cómo se intercambia la energía en reacciones químicas puede conducir al desarrollo de tecnologías más limpias y eficientes.
Fuentes de Energía Renovable
Las fuentes de energía renovable, como la solar y la eólica, dependen de procesos químicos que involucran el intercambio de energía. Por ejemplo, la conversión de energía solar en energía química a través de la fotosíntesis es un modelo que los científicos están intentando replicar en procesos artificiales para producir combustibles limpios. Esto podría revolucionar la manera en que obtenemos y utilizamos energía en el futuro.
Reducción de Residuos
La investigación en el intercambio de energía también ha llevado a la optimización de procesos que generan menos residuos. Al entender cómo maximizar la energía en las reacciones químicas, las industrias pueden minimizar los subproductos no deseados, contribuyendo así a un entorno más sostenible. La biotecnología, por ejemplo, utiliza microorganismos para convertir desechos orgánicos en biocombustibles, cerrando el ciclo de energía y reduciendo el impacto ambiental.
¿Qué es una reacción química exotérmica?
Una reacción química exotérmica es aquella que libera energía al entorno, generalmente en forma de calor. Un ejemplo común es la combustión de combustibles fósiles, donde se libera una gran cantidad de energía. Este tipo de reacciones son fundamentales en muchas aplicaciones industriales, como la generación de energía y procesos de calefacción.
¿Por qué son importantes los catalizadores en las reacciones químicas?
Los catalizadores son importantes porque aumentan la velocidad de las reacciones químicas al reducir la energía de activación necesaria. Esto permite que las reacciones ocurran más rápidamente y con menos energía, lo que es esencial en muchas aplicaciones industriales y biológicas. Sin catalizadores, muchas reacciones serían demasiado lentas para ser útiles.
¿Cómo afecta la temperatura al intercambio de energía en reacciones químicas?
La temperatura afecta el intercambio de energía porque, al aumentar la temperatura, las moléculas se mueven más rápido y colisionan con mayor frecuencia. Esto puede incrementar la velocidad de la reacción y la cantidad de energía intercambiada. En general, las reacciones químicas tienden a ser más rápidas a temperaturas más altas.
¿Qué son las reacciones endotérmicas?
Las reacciones endotérmicas son aquellas que requieren un aporte de energía del entorno para llevarse a cabo. Un ejemplo clásico es la fotosíntesis, donde las plantas absorben energía solar para convertir dióxido de carbono y agua en glucosa. Estas reacciones son esenciales para la vida, ya que almacenan energía en forma de compuestos químicos.
¿Cómo se relaciona el intercambio de energía con la sostenibilidad?
El intercambio de energía está directamente relacionado con la sostenibilidad, ya que entender cómo se producen y utilizan las reacciones químicas puede conducir al desarrollo de tecnologías más limpias y eficientes. Esto incluye el uso de fuentes de energía renovable y la optimización de procesos industriales para reducir residuos y emisiones, contribuyendo a un futuro más sostenible.
¿Qué papel juega el intercambio de energía en la biología?
En biología, el intercambio de energía es crucial para los procesos metabólicos que permiten a los organismos obtener y utilizar energía de los alimentos. Las reacciones químicas dentro de las células convierten nutrientes en formas de energía utilizables, como el ATP, que es fundamental para casi todas las funciones celulares. Sin el adecuado intercambio de energía, los organismos no podrían sobrevivir.
¿Qué aplicaciones tiene el estudio del intercambio de energía en la industria?
El estudio del intercambio de energía tiene aplicaciones significativas en la industria química, donde se utilizan para optimizar procesos, mejorar la eficiencia energética y reducir costos. Desde la producción de plásticos hasta la generación de energía, entender cómo se produce y se intercambia energía es esencial para el desarrollo de procesos más sostenibles y rentables.