Los ácidos y las bases son sustancias que juegan un papel crucial en diversas áreas de la ciencia y la vida cotidiana. Desde la digestión en nuestro cuerpo hasta la fabricación de productos químicos en la industria, estas sustancias son fundamentales. Comprender sus características físicas y químicas no solo es interesante, sino que también es esencial para cualquier persona que quiera profundizar en la química o simplemente entender mejor el mundo que nos rodea. En este artículo, exploraremos las propiedades distintivas de los ácidos y las bases, cómo se comportan en diferentes condiciones y su relevancia en nuestra vida diaria. A medida que avanzamos, desglosaremos estos conceptos en secciones claras y accesibles, asegurando que tengas toda la información necesaria sobre este fascinante tema.
Definición de Ácidos y Bases
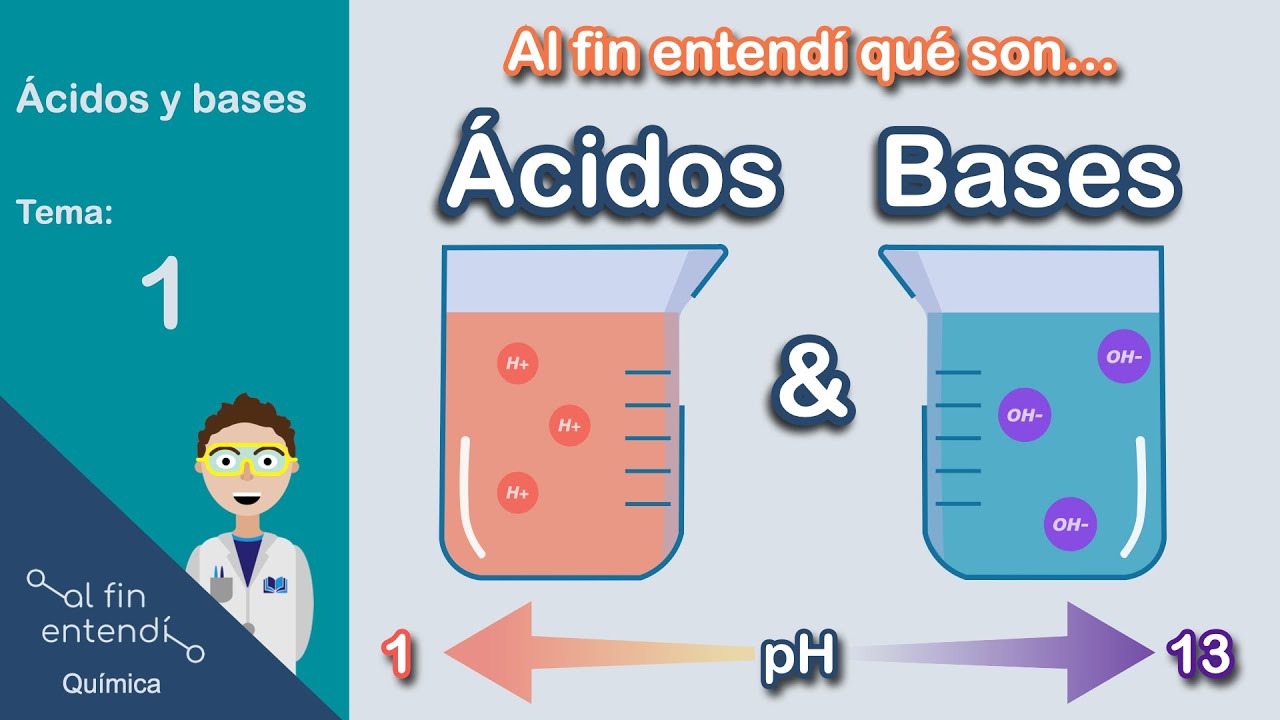
Antes de sumergirnos en las características físicas y químicas de los ácidos y las bases, es importante definir qué son estas sustancias. Los ácidos son compuestos que, al disolverse en agua, liberan iones de hidrógeno (H+). Por otro lado, las bases son compuestos que liberan iones hidróxido (OH-) en solución. Esta diferencia en la liberación de iones es fundamental para entender sus propiedades.
Teorías de Ácidos y Bases
Existen varias teorías que explican el comportamiento de los ácidos y las bases. La teoría de Arrhenius, por ejemplo, establece que los ácidos son sustancias que producen iones H+ en solución, mientras que las bases producen iones OH-. Por otro lado, la teoría de Brønsted-Lowry amplía esta definición al considerar los ácidos como donadores de protones y las bases como aceptores de protones. Esta última teoría es especialmente útil en reacciones que no implican necesariamente agua.
Ejemplos Comunes
Algunos ejemplos comunes de ácidos incluyen el ácido clorhídrico (HCl), que se encuentra en el jugo gástrico, y el ácido acético, presente en el vinagre. En el lado de las bases, el hidróxido de sodio (NaOH), utilizado en productos de limpieza, y el bicarbonato de sodio (NaHCO3), común en la cocina, son representativos. Estos ejemplos no solo ilustran la diversidad de ácidos y bases, sino que también muestran su aplicación en la vida diaria.
Características Físicas de los Ácidos
Los ácidos presentan una serie de características físicas que los distinguen de otras sustancias. Una de las propiedades más notables es su sabor, que suele ser agrio. Además, la mayoría de los ácidos son solubles en agua, lo que les permite ionizarse y liberar iones H+.
Estado Físico
Los ácidos pueden presentarse en estado líquido, sólido o gaseoso. Por ejemplo, el ácido sulfúrico (H2SO4) es un líquido denso y corrosivo, mientras que el ácido clorhídrico se encuentra comúnmente en solución acuosa. En cambio, el ácido carbónico (H2CO3) es un gas en condiciones normales, pero se encuentra en solución en bebidas carbonatadas. La forma en que un ácido se presenta puede influir en su manejo y aplicación en diferentes contextos.
Coloración de Indicadores
Los ácidos también afectan la coloración de ciertos indicadores. Por ejemplo, el tornasol cambia de azul a rojo en presencia de un ácido, lo que permite identificar su presencia de manera sencilla. Esta propiedad es útil en laboratorios y en la industria para verificar la acidez de diversas soluciones.
Características Físicas de las Bases
Las bases, al igual que los ácidos, tienen características físicas únicas. Generalmente, su sabor es amargo y su textura puede ser resbaladiza. La mayoría de las bases también son solubles en agua y pueden ionizarse para liberar iones OH-.
Estado Físico
Las bases suelen encontrarse en forma sólida o líquida. Por ejemplo, el hidróxido de sodio es un sólido blanco que se disuelve fácilmente en agua, formando una solución altamente alcalina. Por otro lado, el hidróxido de calcio (Ca(OH)2) es un sólido que se utiliza en la construcción y la agricultura. La forma física de una base puede determinar su uso en diferentes aplicaciones industriales y químicas.
Reacción con Indicadores
Al igual que los ácidos, las bases también afectan la coloración de los indicadores. Por ejemplo, el tornasol cambia de rojo a azul en presencia de una base. Esta propiedad es esencial para la identificación rápida de soluciones básicas en laboratorios y en la educación química.
Características Químicas de los Ácidos
Las características químicas de los ácidos son esenciales para comprender su comportamiento en reacciones químicas. Una de las propiedades más importantes es su capacidad para reaccionar con metales, lo que a menudo produce hidrógeno gas y sales metálicas.
Reacciones Ácido-Base
Las reacciones entre ácidos y bases son fundamentales en la química. Cuando un ácido reacciona con una base, se produce una sal y agua en un proceso conocido como neutralización. Por ejemplo, cuando el ácido clorhídrico reacciona con el hidróxido de sodio, se forma cloruro de sodio (sal común) y agua. Este tipo de reacción es ampliamente utilizada en la industria para la fabricación de productos químicos y en la regulación del pH en diversas aplicaciones.
Propiedades Corrosivas
Muchos ácidos son corrosivos, lo que significa que pueden dañar materiales y tejidos. Por ejemplo, el ácido sulfúrico puede causar quemaduras graves al contacto con la piel. Esta propiedad corrosiva es un factor crucial a tener en cuenta al manipular ácidos en laboratorios o en la industria, donde se deben seguir estrictas normas de seguridad.
Características Químicas de las Bases
Las bases también presentan características químicas significativas que las distinguen. Una de las más notables es su capacidad para reaccionar con ácidos, lo que resulta en la formación de sales y agua, similar a las reacciones ácido-base mencionadas anteriormente.
Reacciones con Ácidos
Cuando una base reacciona con un ácido, se produce una neutralización que resulta en la formación de una sal y agua. Por ejemplo, el hidróxido de sodio reacciona con el ácido sulfúrico para formar sulfato de sodio y agua. Estas reacciones son esenciales en muchos procesos industriales, como la fabricación de productos químicos y el tratamiento de aguas residuales.
Propiedades Alcalinas
Las bases tienen propiedades alcalinas que pueden neutralizar ácidos. Esto se utiliza en diversas aplicaciones, desde la regulación del pH en suelos agrícolas hasta la fabricación de productos de limpieza. Sin embargo, al igual que los ácidos, algunas bases pueden ser corrosivas, como el hidróxido de sodio, que puede causar quemaduras si no se maneja adecuadamente.
Aplicaciones de Ácidos y Bases en la Vida Diaria
Los ácidos y las bases no son solo conceptos abstractos; tienen aplicaciones prácticas en nuestra vida cotidiana. Desde la cocina hasta la limpieza, estas sustancias son esenciales en una variedad de contextos.
Uso en la Cocina
En la cocina, los ácidos como el vinagre (ácido acético) se utilizan para conservar alimentos y realzar sabores. Por otro lado, el bicarbonato de sodio (una base) se emplea como agente leudante en la repostería, ayudando a que los productos horneados suban. Estos ejemplos muestran cómo los ácidos y las bases son fundamentales para la preparación de alimentos.
Productos de Limpieza
En la limpieza, los ácidos y las bases también juegan un papel crucial. Los productos de limpieza a menudo contienen ácidos, como el ácido cítrico, que ayuda a eliminar manchas y depósitos de cal. Las bases, como el hidróxido de sodio, son eficaces para descomponer grasas y aceites. Comprender cómo funcionan estas sustancias puede ayudarte a elegir los productos de limpieza más adecuados para tus necesidades.
¿Cuál es la diferencia entre un ácido fuerte y un ácido débil?
La diferencia radica en su capacidad para ionizarse en solución. Un ácido fuerte, como el ácido clorhídrico, se ioniza completamente en agua, liberando todos sus iones H+. En cambio, un ácido débil, como el ácido acético, solo se ioniza parcialmente, lo que significa que no todos sus moléculas se convierten en iones H+. Esta diferencia afecta su pH y su reactividad.
¿Cómo se mide la acidez o basicidad de una solución?
La acidez o basicidad se mide utilizando la escala de pH, que va de 0 a 14. Un pH menor a 7 indica una solución ácida, mientras que un pH mayor a 7 indica una solución básica. Un pH de 7 es considerado neutro. Existen indicadores que cambian de color dependiendo del pH, lo que permite una medición visual rápida.
¿Qué ocurre si mezclo un ácido con una base?
Cuando mezclas un ácido con una base, ocurre una reacción de neutralización, que produce una sal y agua. Por ejemplo, si mezclas ácido clorhídrico con hidróxido de sodio, obtienes cloruro de sodio y agua. Esta reacción es fundamental en muchos procesos químicos y es utilizada en diversas aplicaciones industriales.
¿Por qué son importantes los ácidos y bases en la biología?
Los ácidos y bases son cruciales en biología porque participan en muchas reacciones metabólicas. Por ejemplo, el ácido clorhídrico en el estómago ayuda en la digestión de los alimentos, mientras que el bicarbonato de sodio regula el pH en la sangre. Sin un equilibrio adecuado de ácidos y bases, los procesos biológicos pueden verse afectados, lo que puede llevar a problemas de salud.
¿Qué precauciones debo tomar al manejar ácidos y bases?
Al manejar ácidos y bases, es importante usar equipo de protección personal, como guantes y gafas de seguridad, para evitar quemaduras o irritaciones. También se debe trabajar en un área bien ventilada y tener a mano un material neutralizante en caso de derrames. Seguir estas precauciones puede ayudar a prevenir accidentes y garantizar un manejo seguro de estas sustancias.
¿Pueden los ácidos y bases ser utilizados en la agricultura?
Sí, los ácidos y bases tienen aplicaciones en la agricultura. Por ejemplo, el ácido sulfúrico se utiliza en la fabricación de fertilizantes, mientras que las bases como el hidróxido de calcio se utilizan para corregir la acidez del suelo. Estas sustancias son esenciales para optimizar el crecimiento de las plantas y mejorar la productividad agrícola.
¿Cómo se producen los ácidos y bases en la industria?
Los ácidos y bases se producen en la industria a través de procesos químicos específicos. Por ejemplo, el ácido clorhídrico se obtiene mediante la reacción de cloro con hidrógeno, mientras que el hidróxido de sodio se produce mediante la electrólisis de la salmuera. Estos procesos industriales son fundamentales para satisfacer la demanda de estas sustancias en diversas aplicaciones, desde la fabricación de productos químicos hasta el tratamiento de aguas.