El agua, esa sustancia vital que compone aproximadamente el 70% de nuestro planeta y del cuerpo humano, es mucho más que un simple líquido. Sus reacciones químicas son fundamentales para la vida tal como la conocemos. Desde el proceso de fotosíntesis hasta la disolución de sales, el agua participa en una variedad de reacciones que son cruciales para los ecosistemas, la industria y nuestra salud. En este artículo, exploraremos en profundidad las reacciones químicas del agua, presentando ejemplos clave y analizando su importancia en diferentes contextos. Aprenderemos sobre cómo el agua actúa como solvente, su papel en reacciones ácido-base, y su participación en procesos biológicos y ambientales. Prepárate para sumergirte en el fascinante mundo de la química del agua.
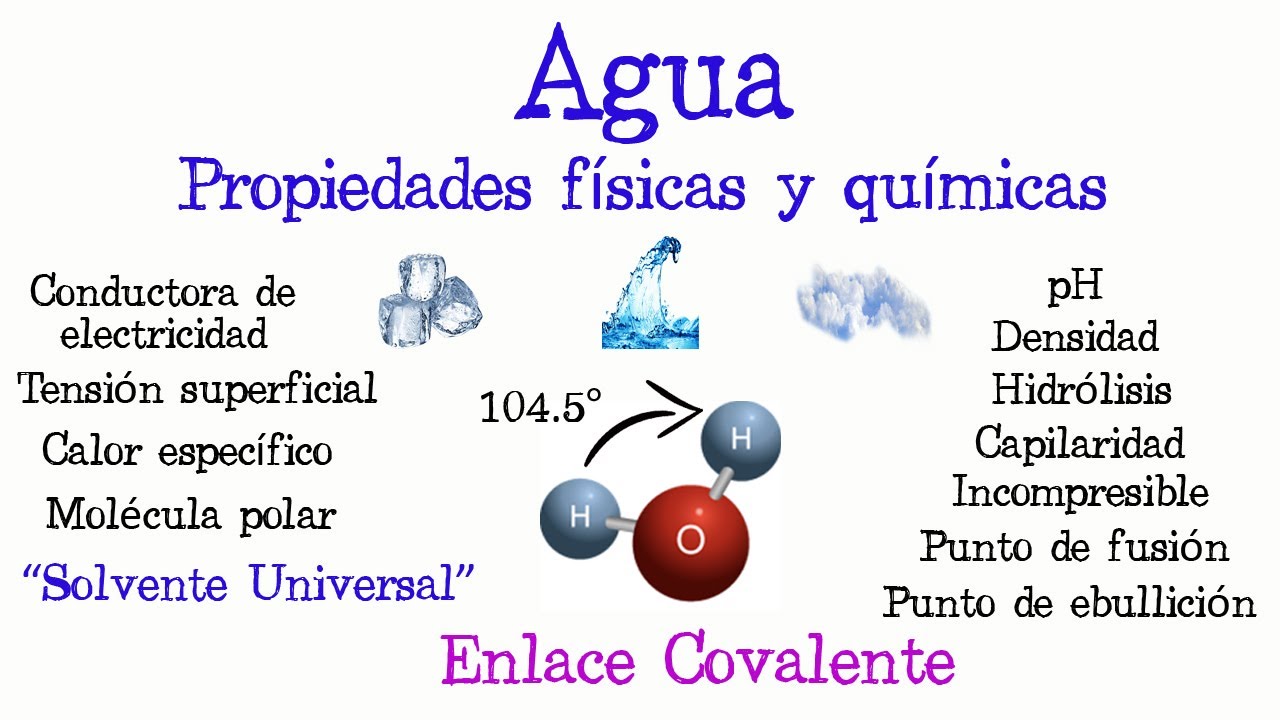
El Agua como Solvente Universal
Una de las propiedades más destacadas del agua es su capacidad para disolver una amplia variedad de sustancias, lo que le ha valido el título de «solvente universal». Esta propiedad se debe a su estructura molecular, donde un átomo de oxígeno está unido a dos átomos de hidrógeno, formando un dipolo eléctrico. Esto permite que las moléculas de agua interactúen con otras moléculas, facilitando diversas reacciones químicas.
Interacciones con Iones y Moléculas Polares
Cuando el agua se encuentra con compuestos iónicos, como la sal (NaCl), las moléculas de agua rodean los iones de sodio y cloruro. Este proceso, conocido como solvatación, permite que los iones se separen y se dispersen en la solución. Por ejemplo, al disolver sal en agua, los iones Na+ y Cl– se separan, lo que permite que la sal se distribuya uniformemente. Esta propiedad es esencial en muchos procesos biológicos, como la transmisión de impulsos nerviosos y la regulación de la presión osmótica en las células.
Además, el agua puede interactuar con moléculas polares, como el azúcar. Al igual que con los iones, las moléculas de agua se adhieren a las moléculas de azúcar, permitiendo que se disuelvan. Esta capacidad de disolución es vital en el metabolismo, ya que muchas reacciones químicas en los organismos vivos requieren que los reactivos estén en solución.
Reacciones de Hidratación
Las reacciones de hidratación son otro aspecto crucial de cómo el agua participa en las reacciones químicas. Estas reacciones implican la adición de agua a un compuesto, lo que puede resultar en la formación de nuevos productos. Un ejemplo clásico es la hidratación de los carbonatos, donde el agua se combina con dióxido de carbono para formar ácido carbónico, un componente esencial en el ciclo del carbono.
Las reacciones de hidratación también son fundamentales en la industria, como en la producción de etanol a partir de etileno. Aquí, el agua se añade al etileno en presencia de un catalizador, produciendo etanol, un producto clave en la fabricación de combustibles y productos químicos.
Reacciones Ácido-Base en el Agua
El agua no solo actúa como un solvente, sino que también juega un papel crítico en las reacciones ácido-base. El concepto de pH, que mide la acidez o basicidad de una solución, es fundamental para entender cómo el agua interactúa con otras sustancias. En su forma pura, el agua tiene un pH de 7, lo que la clasifica como neutra. Sin embargo, al agregar ácidos o bases, su pH puede cambiar, afectando las reacciones químicas que pueden ocurrir.
El Agua como Ácido y Base
El agua puede actuar tanto como un ácido como una base, lo que se conoce como amfoterismo. Esto significa que puede donar protones (H+) o aceptar protones, dependiendo de la sustancia con la que interactúa. Por ejemplo, en una reacción con ácido clorhídrico (HCl), el agua actúa como una base al aceptar un protón, formando el ion hidronio (H3O+). Por otro lado, al reaccionar con una base como el hidróxido de sodio (NaOH), el agua actúa como un ácido, donando un protón y formando iones hidróxido (OH–).
Importancia en Procesos Biológicos
Las reacciones ácido-base en el agua son esenciales para la vida. En los organismos, el pH del medio interno debe mantenerse dentro de un rango específico para que las enzimas funcionen correctamente. Por ejemplo, en el cuerpo humano, la sangre tiene un pH ligeramente alcalino (entre 7.35 y 7.45). Cualquier desviación significativa de este rango puede tener consecuencias graves para la salud, como acidosis o alcalosis.
Además, muchas reacciones metabólicas dependen del equilibrio ácido-base. La fotosíntesis, por ejemplo, implica la producción de glucosa y oxígeno a partir de dióxido de carbono y agua, y este proceso es influenciado por el pH del medio en el que ocurre.
Reacciones Redox y el Agua
Las reacciones de oxidación-reducción, o redox, son fundamentales en la química del agua. Estas reacciones implican la transferencia de electrones entre sustancias, y el agua juega un papel crucial en muchos de estos procesos. En particular, el agua es un agente oxidante y reductor en diversas reacciones químicas.
Ejemplos de Reacciones Redox
Un ejemplo clásico de una reacción redox que involucra agua es la fotosíntesis. Durante este proceso, el agua se oxida, liberando oxígeno como subproducto. Las moléculas de agua se dividen en oxígeno y protones a través de un proceso conocido como fotólisis. Este oxígeno es esencial para la vida en la Tierra, ya que es utilizado por los organismos para la respiración celular.
Otro ejemplo es la corrosión del hierro, donde el agua actúa como un medio para la oxidación del hierro, formando óxido de hierro (herrumbre). Este proceso es un claro recordatorio de cómo el agua, aunque vital, también puede ser un agente destructivo en ciertas condiciones.
Reacciones Redox en la Industria
Las reacciones redox son fundamentales en la industria, especialmente en la producción de energía. En las pilas de combustible, por ejemplo, el agua se genera como un subproducto de la reacción entre el hidrógeno y el oxígeno. Este proceso no solo es eficiente, sino que también es una fuente de energía limpia, ya que el único subproducto es el agua.
El Agua en el Ciclo del Carbono
El ciclo del carbono es un proceso natural que describe cómo el carbono se mueve a través de la Tierra, la atmósfera y los océanos. El agua es un componente clave en este ciclo, facilitando varias reacciones químicas que son esenciales para la vida en el planeta.
Fotosíntesis y Respiración
La fotosíntesis es quizás la reacción más conocida que involucra agua en el ciclo del carbono. Durante este proceso, las plantas utilizan agua, dióxido de carbono y luz solar para producir glucosa y oxígeno. Este proceso no solo es vital para la producción de alimentos, sino que también juega un papel crucial en la regulación del CO2 en la atmósfera.
La respiración celular, por otro lado, es el proceso inverso. Los organismos consumen glucosa y oxígeno para producir energía, liberando dióxido de carbono y agua como subproductos. Este ciclo de reacciones es fundamental para mantener el equilibrio del carbono en la naturaleza.
Impacto en el Cambio Climático
El agua también tiene un papel crucial en el cambio climático. La evaporación del agua de los océanos contribuye a la formación de nubes y precipitación, lo que influye en el clima global. Además, el agua absorbe grandes cantidades de calor, lo que ayuda a regular la temperatura de la Tierra. Sin embargo, los cambios en el uso de la tierra y la contaminación pueden afectar la calidad del agua y, por ende, su capacidad para participar en estos procesos naturales.
Reacciones Químicas del Agua en la Industria
Las reacciones químicas del agua no solo son importantes en la naturaleza, sino que también tienen aplicaciones industriales significativas. Desde la producción de productos químicos hasta el tratamiento de aguas residuales, el agua es un componente esencial en numerosos procesos industriales.
Producción de Productos Químicos
En la industria química, el agua se utiliza como reactivo en una variedad de procesos. Por ejemplo, en la síntesis de ácido sulfúrico, el agua se combina con trióxido de azufre (SO3) para formar ácido sulfúrico (H2SO4). Este ácido es uno de los productos químicos más producidos en el mundo y tiene aplicaciones en la fabricación de fertilizantes, explosivos y productos de limpieza.
Otro ejemplo es la producción de hidróxido de sodio (NaOH) a través de la electrólisis de una solución de sal, donde el agua juega un papel crucial en la generación de este importante compuesto industrial.
Tratamiento de Aguas Residuales
El tratamiento de aguas residuales es otro campo donde las reacciones químicas del agua son esenciales. En las plantas de tratamiento, el agua se somete a diversas reacciones químicas para eliminar contaminantes y mejorar su calidad antes de ser devuelta al medio ambiente. Procesos como la coagulación, floculación y desinfección utilizan el agua como medio para eliminar impurezas y patógenos, garantizando así que el agua tratada sea segura para su uso.
¿Por qué el agua se considera un solvente universal?
El agua es considerada un solvente universal debido a su capacidad para disolver una amplia gama de sustancias, tanto iónicas como moleculares. Esto se debe a su estructura polar, que permite interacciones efectivas con otros compuestos, facilitando reacciones químicas esenciales para la vida.
¿Qué son las reacciones de hidratación y por qué son importantes?
Las reacciones de hidratación implican la adición de agua a un compuesto, formando nuevos productos. Son importantes porque permiten procesos como la formación de ácido carbónico en el ciclo del carbono y son clave en muchas reacciones industriales, como la producción de etanol.
¿Cómo afecta el pH del agua a las reacciones químicas?
El pH del agua puede influir significativamente en las reacciones químicas, ya que determina si el agua actúa como un ácido o una base. Esto es crucial en procesos biológicos, ya que muchas enzimas requieren un pH específico para funcionar correctamente.
¿Qué papel juega el agua en el ciclo del carbono?
El agua es un componente clave en el ciclo del carbono, facilitando reacciones como la fotosíntesis y la respiración celular. Estas reacciones ayudan a regular los niveles de dióxido de carbono en la atmósfera y son esenciales para la producción de energía en los organismos vivos.
¿Cuáles son algunas aplicaciones industriales del agua en reacciones químicas?
El agua se utiliza en diversas aplicaciones industriales, como en la producción de productos químicos (por ejemplo, ácido sulfúrico y hidróxido de sodio) y en el tratamiento de aguas residuales, donde se somete a reacciones químicas para eliminar contaminantes y mejorar la calidad del agua.
¿Por qué es importante estudiar las reacciones químicas del agua?
Estudiar las reacciones químicas del agua es fundamental porque el agua es esencial para la vida y participa en innumerables procesos biológicos, industriales y ambientales. Comprender estas reacciones nos ayuda a manejar mejor nuestros recursos hídricos y a proteger el medio ambiente.
¿El agua puede ser un agente oxidante y reductor?
Sí, el agua puede actuar como un agente oxidante y reductor en diversas reacciones químicas. Su capacidad para donar o aceptar electrones la convierte en un participante clave en reacciones redox, como en la fotosíntesis y la corrosión de metales.