La energía libre estándar de formación es un concepto fundamental en la química y la termodinámica que permite entender cómo se producen y se transforman las reacciones químicas. Si alguna vez te has preguntado por qué ciertas reacciones ocurren de forma espontánea mientras que otras requieren un aporte energético, este artículo es para ti. La energía libre de Gibbs, que es la forma más común de energía libre en este contexto, juega un papel crucial en la predicción de la dirección y el equilibrio de las reacciones químicas. En este artículo, exploraremos qué es la energía libre estándar de formación, cómo se calcula, su importancia en diferentes áreas de la ciencia y la tecnología, así como algunos ejemplos prácticos que ilustran su aplicación. Además, responderemos a las preguntas más frecuentes sobre este fascinante tema.
¿Qué es la Energía Libre Estándar de Formación?
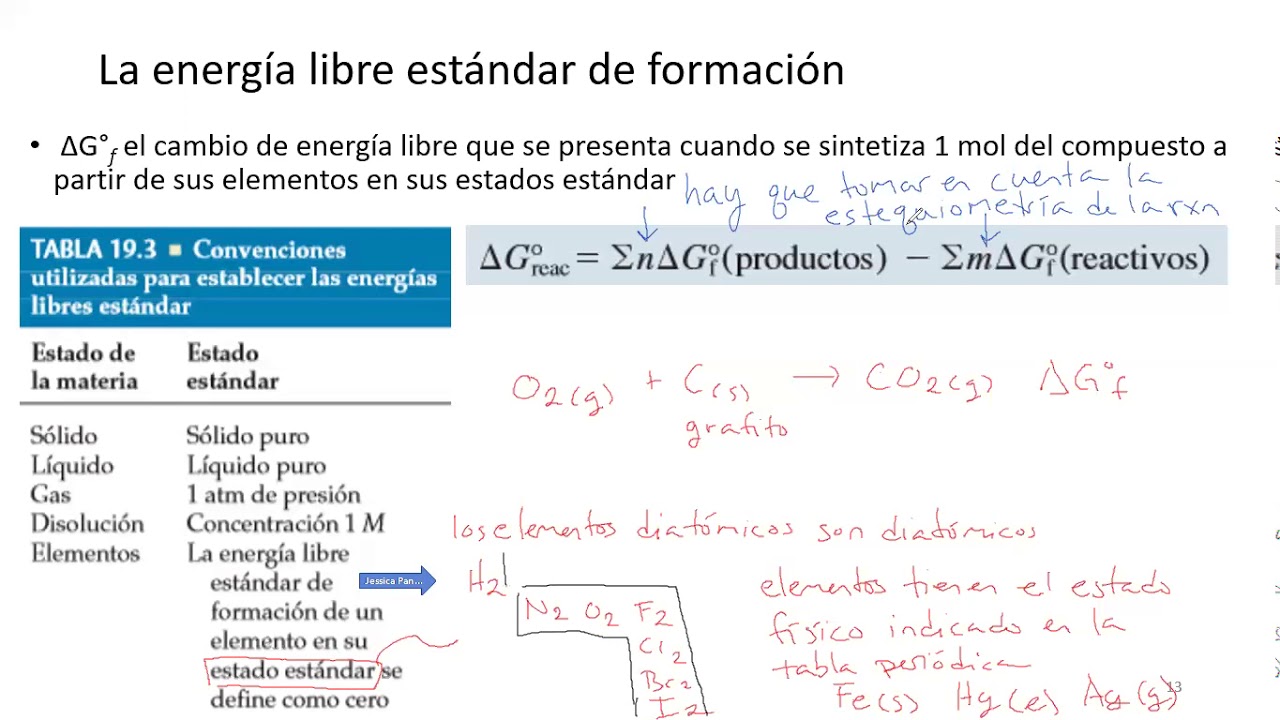
La energía libre estándar de formación se refiere a la cantidad de energía libre de Gibbs que se libera o se absorbe cuando un mol de un compuesto se forma a partir de sus elementos en su estado más estable a una temperatura y presión específicas, generalmente 25 °C y 1 atm. Este concepto es fundamental porque permite cuantificar la tendencia de una reacción química a ocurrir.
Definición y Contexto
La energía libre de Gibbs, que se utiliza para calcular la energía libre estándar de formación, es una medida de la energía que está disponible para realizar trabajo en condiciones constantes de temperatura y presión. La energía libre estándar de formación se asigna un valor de cero para los elementos en su estado más estable, lo que significa que cualquier otro compuesto tendrá un valor positivo o negativo dependiendo de si se libera o se consume energía durante su formación.
Por ejemplo, el agua (H₂O) tiene una energía libre estándar de formación negativa porque se libera energía cuando el hidrógeno y el oxígeno se combinan para formar agua. En cambio, si consideramos un compuesto inestable, como el ozono (O₃), su energía libre estándar de formación será mayor, ya que requiere más energía para mantenerse en ese estado.
Importancia en Química
La energía libre estándar de formación es crucial para predecir la dirección de las reacciones químicas. Si el cambio de energía libre de Gibbs de una reacción es negativo, la reacción es espontánea; si es positivo, la reacción no ocurrirá sin un aporte externo de energía. Este principio es la base de la termodinámica química y se aplica en diversas áreas, desde la biología hasta la ingeniería química.
Por ejemplo, en procesos biológicos, la energía libre de Gibbs ayuda a entender cómo las enzimas catalizan reacciones que, de otro modo, no serían espontáneas. Además, en la industria, se utiliza para optimizar procesos de producción y minimizar costos energéticos.
Cálculo de la Energía Libre Estándar de Formación
Calcular la energía libre estándar de formación implica conocer las energías libres de los reactivos y productos de una reacción química. La fórmula básica que se utiliza es:
ΔG° = Σ(energía libre de formación de productos) – Σ(energía libre de formación de reactivos)
Ejemplo de Cálculo
Imaginemos que queremos calcular la energía libre estándar de formación de la reacción de formación del agua a partir de hidrógeno y oxígeno. Si tenemos los valores de energía libre de formación de H₂ y O₂ (que son cero, ya que son elementos en su estado más estable) y el valor de H₂O, podemos aplicar la fórmula mencionada.
Supongamos que la energía libre de formación de H₂O es -237.13 kJ/mol. Entonces, al aplicar la fórmula:
ΔG° = [(-237.13 kJ/mol)] – [0 + 0] = -237.13 kJ/mol
Este resultado indica que la formación de agua es un proceso espontáneo y libera energía.
Factores que Afectan la Energía Libre
La energía libre estándar de formación puede verse afectada por varios factores:
1. Temperatura: A temperaturas más altas, algunas reacciones que son no espontáneas a temperatura ambiente pueden volverse espontáneas.
2. Presión: En reacciones que involucran gases, un aumento de presión puede favorecer la formación de productos.
3. Concentración de reactivos y productos: Cambiar la concentración de las sustancias puede desplazar el equilibrio de la reacción, afectando así la energía libre.
Es fundamental considerar estos factores al aplicar la energía libre estándar de formación en situaciones prácticas, como en la industria química o en procesos biológicos.
Aplicaciones de la Energía Libre Estándar de Formación
La energía libre estándar de formación tiene aplicaciones en diversas áreas, que van desde la investigación científica hasta la industria.
Industria Química
En la industria química, la energía libre se utiliza para diseñar procesos de producción eficientes. Por ejemplo, en la producción de amoníaco a través del proceso Haber-Bosch, se estudia la energía libre de Gibbs para maximizar la producción y minimizar el uso de energía.
Los ingenieros químicos pueden predecir qué condiciones de temperatura y presión llevarán a una mayor eficiencia en la producción de amoníaco, lo que resulta en un proceso más económico y menos contaminante.
Biología y Bioquímica
En biología, la energía libre estándar de formación es crucial para entender cómo funcionan las enzimas. Las enzimas son catalizadores biológicos que aceleran las reacciones químicas al reducir la energía de activación necesaria para que ocurran. Conocer la energía libre de Gibbs permite a los científicos comprender mejor cómo las enzimas pueden facilitar reacciones que de otro modo serían muy lentas.
Por ejemplo, en la respiración celular, la energía liberada por la oxidación de la glucosa se utiliza para sintetizar ATP, la moneda energética de la célula. La comprensión de la energía libre de Gibbs en este contexto es esencial para investigar enfermedades metabólicas y desarrollar tratamientos.
Relación con el Equilibrio Químico
La energía libre estándar de formación también está estrechamente relacionada con el concepto de equilibrio químico. En un sistema en equilibrio, la energía libre de Gibbs es mínima, lo que significa que no hay una tendencia neta hacia la formación de productos o reactivos.
Desplazamiento del Equilibrio
Cuando se altera un sistema en equilibrio, por ejemplo, cambiando la temperatura o la presión, la reacción puede desplazarse hacia la formación de más productos o más reactivos. Este fenómeno se puede analizar utilizando el principio de Le Chatelier, que establece que un sistema en equilibrio reaccionará para contrarrestar cualquier cambio aplicado.
Por ejemplo, si aumentamos la concentración de reactivos, el sistema buscará disminuir esa concentración favoreciendo la formación de productos. Esto es fundamental en la síntesis química, donde se busca optimizar la producción de compuestos deseados.
Cálculo de la Constante de Equilibrio
La relación entre la energía libre estándar de formación y la constante de equilibrio (K) se establece mediante la siguiente ecuación:
ΔG° = -RT ln(K)
Donde R es la constante de los gases y T es la temperatura en Kelvin. A partir de esta relación, se puede calcular la constante de equilibrio para una reacción dada, lo que permite predecir la dirección en la que la reacción favorece a los productos o reactivos.
Consideraciones Prácticas y Ejemplos Reales
Entender la energía libre estándar de formación no solo es relevante en un contexto teórico, sino que tiene aplicaciones prácticas que pueden observarse en la vida diaria.
Reacciones Cotidianas
Un ejemplo sencillo es la combustión de combustibles fósiles. Al quemar gasolina, se libera una gran cantidad de energía, lo que indica que la energía libre estándar de formación de los productos (dióxido de carbono y agua) es menor que la de los reactivos (hidrocarburos y oxígeno). Esto se traduce en la energía que utilizamos para mover nuestros vehículos.
Innovaciones Tecnológicas
En el ámbito de la tecnología, la energía libre de Gibbs se aplica en el desarrollo de baterías y celdas de combustible. Por ejemplo, en una celda de combustible de hidrógeno, se estudia la energía libre de formación del agua para maximizar la eficiencia del proceso de conversión de energía. Este tipo de tecnología es clave para avanzar hacia fuentes de energía más limpias y sostenibles.
¿Cuál es la diferencia entre energía libre estándar de formación y energía de activación?
La energía libre estándar de formación se refiere a la energía asociada con la formación de un mol de un compuesto a partir de sus elementos en su estado más estable, mientras que la energía de activación es la energía necesaria para iniciar una reacción química. En otras palabras, la energía de activación es el «impulso» que se necesita para que la reacción ocurra, mientras que la energía libre de formación indica si la reacción es espontánea o no.
¿Se puede cambiar la energía libre estándar de formación de un compuesto?
No se puede cambiar la energía libre estándar de formación de un compuesto en sí, ya que es una propiedad intrínseca basada en la estructura del compuesto y su estado. Sin embargo, se pueden modificar las condiciones de temperatura, presión y concentración para influir en la dirección de las reacciones que involucran ese compuesto.
¿Cómo afecta la temperatura a la energía libre estándar de formación?
La temperatura puede afectar la energía libre estándar de formación y, por ende, la espontaneidad de una reacción. A temperaturas más altas, algunas reacciones que son no espontáneas a temperatura ambiente pueden volverse espontáneas debido a cambios en la entropía y la energía interna del sistema.
¿Por qué es importante conocer la energía libre estándar de formación en biología?
Conocer la energía libre estándar de formación es crucial en biología porque ayuda a entender cómo ocurren las reacciones bioquímicas en organismos vivos. Esto es esencial para el estudio de procesos metabólicos, la acción de enzimas y el desarrollo de fármacos.
¿Qué rol juega la energía libre estándar de formación en la sostenibilidad?
La energía libre estándar de formación es fundamental en el desarrollo de tecnologías sostenibles, como celdas de combustible y biocombustibles. Comprender cómo se libera y se utiliza la energía en estas reacciones puede ayudar a diseñar procesos más eficientes y menos contaminantes.
¿Puede la energía libre estándar de formación ser positiva y negativa?
Sí, la energía libre estándar de formación puede ser tanto positiva como negativa. Un valor negativo indica que la formación del compuesto es espontánea y libera energía, mientras que un valor positivo sugiere que se necesita un aporte de energía para formar el compuesto.
¿Cómo se relaciona la energía libre estándar de formación con la química ambiental?
En química ambiental, la energía libre estándar de formación se utiliza para entender y predecir la estabilidad de compuestos en el medio ambiente. Esto es esencial para evaluar la biodegradabilidad de sustancias químicas y su impacto en ecosistemas naturales.