La química de las soluciones es un tema fascinante que abarca una amplia variedad de conceptos, desde la disolución de sustancias hasta las interacciones moleculares. Una pregunta que surge frecuentemente es: ¿es la disolución de un sólido iónico en agua un proceso endotérmico? Entender si este proceso absorbe o libera calor es crucial no solo para los estudiantes de química, sino también para profesionales en campos como la farmacología, la ingeniería y la biología. En este artículo, exploraremos en profundidad esta cuestión, analizando las características de los sólidos iónicos, los principios termodinámicos involucrados en su disolución, y las implicaciones prácticas de estos fenómenos. Acompáñanos en este viaje para descubrir las conclusiones clave sobre la disolución de sólidos iónicos en agua y su importancia en diversas aplicaciones.
Fundamentos de la Disolución de Sólidos Iónicos
Para abordar la pregunta sobre si la disolución de un sólido iónico en agua es endotérmica, es esencial entender qué son los sólidos iónicos y cómo se comportan en solución. Los sólidos iónicos son compuestos formados por la unión de cationes y aniones a través de enlaces iónicos, que son interacciones electrostáticas muy fuertes. Ejemplos comunes incluyen el cloruro de sodio (NaCl) y el sulfato de magnesio (MgSO₄).
Estructura y Propiedades de los Sólidos Iónicos
La estructura cristalina de los sólidos iónicos se caracteriza por una disposición ordenada de iones que maximiza las interacciones electrostáticas entre ellos. Esta organización resulta en propiedades únicas, como altos puntos de fusión y ebullición, así como una dureza considerable. Sin embargo, cuando se introducen en un solvente como el agua, estas estructuras pueden cambiar drásticamente.
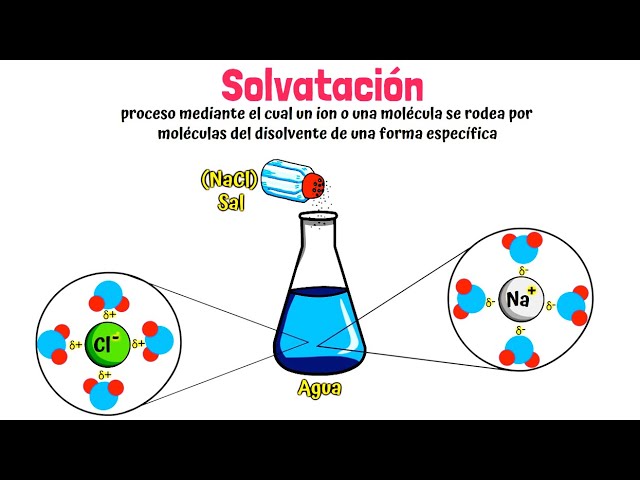
La polaridad del agua juega un papel crucial en la disolución de sólidos iónicos. Las moléculas de agua tienen un dipolo eléctrico, lo que les permite interactuar con los iones. Al entrar en contacto con un sólido iónico, las moléculas de agua rodean a los iones y comienzan a separarlos, un proceso conocido como solvatación.
Proceso de Disolución
El proceso de disolución implica varias etapas, que se pueden resumir en los siguientes pasos:
- Ruptura de la red iónica: Se necesita energía para superar las fuerzas de atracción entre los iones en el sólido.
- Interacción con el agua: Las moléculas de agua se acercan y rodean a los iones, formando enlaces de hidrógeno y permitiendo que se disuelvan.
- Establecimiento de un equilibrio: Una vez que los iones están en solución, se establece un equilibrio dinámico entre los iones disueltos y el sólido.
Termodinámica de la Disolución
Para entender si la disolución de un sólido iónico en agua es endotérmica, debemos considerar los conceptos de entalpía y energía libre de Gibbs. La entalpía de disolución se refiere al calor absorbido o liberado durante el proceso de disolución, y es un indicador clave para determinar si el proceso es endotérmico o exotérmico.
Procesos Endotérmicos y Exotérmicos
Un proceso es considerado endotérmico cuando absorbe calor del entorno, resultando en una disminución de la temperatura del sistema. Por otro lado, un proceso exotérmico libera calor, lo que aumenta la temperatura del sistema. En el contexto de la disolución, si la entalpía de disolución es positiva, el proceso es endotérmico; si es negativa, es exotérmico.
Determinación de la Entalpía de Disolución
La entalpía de disolución se puede determinar experimentalmente mediante calorimetría. Al disolver un sólido iónico en agua, se mide el cambio de temperatura del sistema. Por ejemplo, al disolver cloruro de sodio en agua, se observa que la temperatura del agua disminuye, lo que sugiere que el proceso es endotérmico.
En general, muchos sólidos iónicos, como el nitrato de amonio (NH₄NO₃), tienen entalpías de disolución positivas, lo que implica que su disolución es un proceso endotérmico. Sin embargo, hay excepciones y es importante considerar cada caso de manera individual.
Ejemplos de Sólidos Iónicos y su Comportamiento en Agua
La respuesta a si la disolución de un sólido iónico en agua es endotérmica puede variar según el compuesto específico. A continuación, examinaremos algunos ejemplos comunes y su comportamiento al disolverse en agua.
Cloruro de Sodio (NaCl)
El cloruro de sodio es uno de los sólidos iónicos más conocidos y se utiliza frecuentemente en la cocina. Al disolverse en agua, el NaCl se separa en iones de sodio (Na⁺) y cloruro (Cl⁻). Este proceso es ligeramente endotérmico, lo que significa que se requiere un poco de energía para romper la red iónica, resultando en una ligera disminución de la temperatura del agua.
Nitrato de Amonio (NH₄NO₃)
El nitrato de amonio es otro sólido iónico que se disuelve en agua de manera endotérmica. Este compuesto se utiliza comúnmente en fertilizantes y su disolución es notablemente fría, lo que puede observarse al tocar el recipiente en el que se disuelve. Este efecto es utilizado en paquetes de frío instantáneos.
Sulfato de Magnesio (MgSO₄)
El sulfato de magnesio, conocido como sal de Epsom, también se disuelve en agua, pero su comportamiento es diferente. Al disolverse, el proceso es menos endotérmico en comparación con el nitrato de amonio, aunque aún puede absorber algo de calor del entorno. Este compuesto se utiliza a menudo en baños relajantes.
Implicaciones Prácticas de la Disolución Endotérmica
Comprender si la disolución de un sólido iónico en agua es endotérmica tiene diversas implicaciones prácticas en la vida cotidiana y en la industria. Estas son algunas áreas donde este conocimiento es particularmente valioso:
Aplicaciones en la Industria Alimentaria
En la industria alimentaria, el conocimiento sobre la disolución endotérmica de ciertos compuestos, como el cloruro de sodio, es esencial para el proceso de conservación de alimentos. Al disolver sal en agua, se puede crear un ambiente que inhibe el crecimiento de bacterias, lo que es fundamental para la conservación de productos.
Uso en Productos Químicos y Farmacéuticos
En la industria farmacéutica, el entendimiento de la termodinámica de la disolución es crucial para el diseño de medicamentos. Algunos fármacos requieren una disolución controlada para garantizar que se absorban adecuadamente en el organismo. La elección de excipientes y la formulación de productos puede depender de si un compuesto es endotérmico o exotérmico al disolverse.
Aplicaciones en el Hogar
En el hogar, los productos que utilizan la disolución endotérmica, como los paquetes de frío instantáneo, son ejemplos claros de cómo este fenómeno se aplica en la vida diaria. Estos paquetes son útiles para aliviar lesiones y reducir la inflamación, y funcionan gracias a la disolución endotérmica de compuestos como el nitrato de amonio.
¿Por qué algunos sólidos iónicos son más solubles que otros en agua?
La solubilidad de un sólido iónico en agua depende de varios factores, incluyendo la fuerza de los enlaces iónicos en el sólido y la polaridad del agua. Sólidos con enlaces iónicos más débiles tienden a ser más solubles, ya que requieren menos energía para separarse en iones. Además, la interacción entre las moléculas de agua y los iones también influye en la solubilidad.
¿Qué sucede si se disuelve un sólido iónico en un solvente no polar?
Cuando un sólido iónico se disuelve en un solvente no polar, como el hexano, la disolución no ocurrirá de manera efectiva. Esto se debe a que los sólidos iónicos son polares y no interactúan favorablemente con solventes no polares. La regla «lo similar disuelve lo similar» se aplica aquí, lo que significa que los compuestos polares tienden a disolverse en solventes polares.
¿La temperatura del agua afecta la disolución de sólidos iónicos?
Sí, la temperatura del agua puede afectar la disolución de sólidos iónicos. Generalmente, un aumento en la temperatura del agua puede aumentar la solubilidad de muchos sólidos iónicos, ya que proporciona más energía para romper los enlaces iónicos. Sin embargo, hay excepciones, y algunos compuestos pueden ser menos solubles a temperaturas más altas.
¿Cómo se relaciona la disolución endotérmica con la temperatura ambiental?
La disolución endotérmica puede afectar la temperatura ambiental de un sistema. Al absorber calor del entorno, la temperatura del agua o del medio donde ocurre la disolución puede disminuir, lo que puede ser ventajoso en ciertas aplicaciones, como en el enfriamiento de lesiones.
¿Qué papel juega la presión en la disolución de sólidos iónicos?
En general, la presión tiene un efecto menor en la disolución de sólidos iónicos en comparación con los gases. Sin embargo, en situaciones donde se involucran gases disueltos, un aumento de presión puede aumentar la solubilidad. Para sólidos, la presión no suele ser un factor determinante, aunque puede influir en ciertos sistemas específicos.
¿Es posible medir la entalpía de disolución en casa?
Sí, es posible medir la entalpía de disolución en casa utilizando un calorímetro simple, como un termómetro y un recipiente aislante. Al disolver un sólido iónico en agua, puedes registrar el cambio de temperatura y calcular la entalpía de disolución. Este experimento puede ser educativo y demostrar los principios de la termodinámica de manera práctica.