La química es una de las ciencias más fascinantes, y entender sus fundamentos es esencial para desentrañar los misterios de la materia y sus transformaciones. En este contexto, los reactivos y productos juegan un papel crucial en el estudio de las reacciones químicas. ¿Alguna vez te has preguntado cómo se transforma una sustancia en otra durante una reacción? La respuesta radica en la comprensión de los reactivos y productos en una ecuación química. Este artículo te guiará a través de los conceptos básicos, la importancia de estos elementos y su función en diversas reacciones. Desde la identificación de reactivos hasta la interpretación de productos, te proporcionaremos un análisis detallado que te permitirá comprender mejor este fascinante tema.
¿Qué son los Reactivos y Productos?
Para empezar, es fundamental definir qué son los reactivos y productos en el contexto de una ecuación química. Los reactivos son las sustancias que participan en una reacción química, mientras que los productos son las sustancias que se generan como resultado de esa reacción. Esta distinción es esencial, ya que nos permite entender cómo se produce un cambio en la materia.
Definición de Reactivos
Los reactivos son los componentes iniciales de una reacción química. Cuando se lleva a cabo una reacción, estos se combinan o se transforman para formar nuevos compuestos. Por ejemplo, en la reacción de la combustión del metano (CH₄), el metano y el oxígeno (O₂) son los reactivos. Estos se combinan para producir dióxido de carbono (CO₂) y agua (H₂O) como productos. Es importante notar que los reactivos pueden ser elementos químicos, compuestos o incluso mezclas.
Definición de Productos
Los productos, por otro lado, son las sustancias que resultan de la reacción química. En el ejemplo anterior de la combustión del metano, el dióxido de carbono y el agua son los productos. La formación de productos implica un cambio en la estructura y propiedades de los reactivos. Es crucial entender que en una reacción química, la cantidad total de materia se conserva, lo que significa que la masa de los reactivos es igual a la masa de los productos. Este principio se conoce como la ley de conservación de la masa.
La Importancia de los Reactivos y Productos en la Química
Comprender la función de los reactivos y productos en una ecuación química no solo es fundamental para los estudiantes de química, sino también para cualquier persona interesada en la ciencia. Estos conceptos son la base de muchas aplicaciones prácticas en la vida diaria y en la industria.
Aplicaciones en la Industria Química
En la industria química, la identificación y manipulación de reactivos y productos son esenciales para la producción de una amplia gama de sustancias. Por ejemplo, en la fabricación de plásticos, los reactivos pueden ser monómeros que se combinan para formar polímeros. Los productos de esta reacción son los plásticos que utilizamos en múltiples aplicaciones, desde envases hasta componentes electrónicos. Además, el conocimiento de los reactivos y productos permite a los químicos optimizar procesos, aumentar la eficiencia y reducir el impacto ambiental.
Reacciones Biológicas
En el ámbito biológico, los reactivos y productos son cruciales para entender cómo funcionan los organismos. Por ejemplo, en la fotosíntesis, las plantas utilizan dióxido de carbono y agua como reactivos para producir glucosa y oxígeno. Estos productos son esenciales para la vida en la Tierra, ya que la glucosa proporciona energía y el oxígeno es vital para la respiración de muchos organismos. Sin la comprensión de estos reactivos y productos, sería difícil entender los procesos biológicos fundamentales.
Cómo Leer y Escribir Ecuaciones Químicas
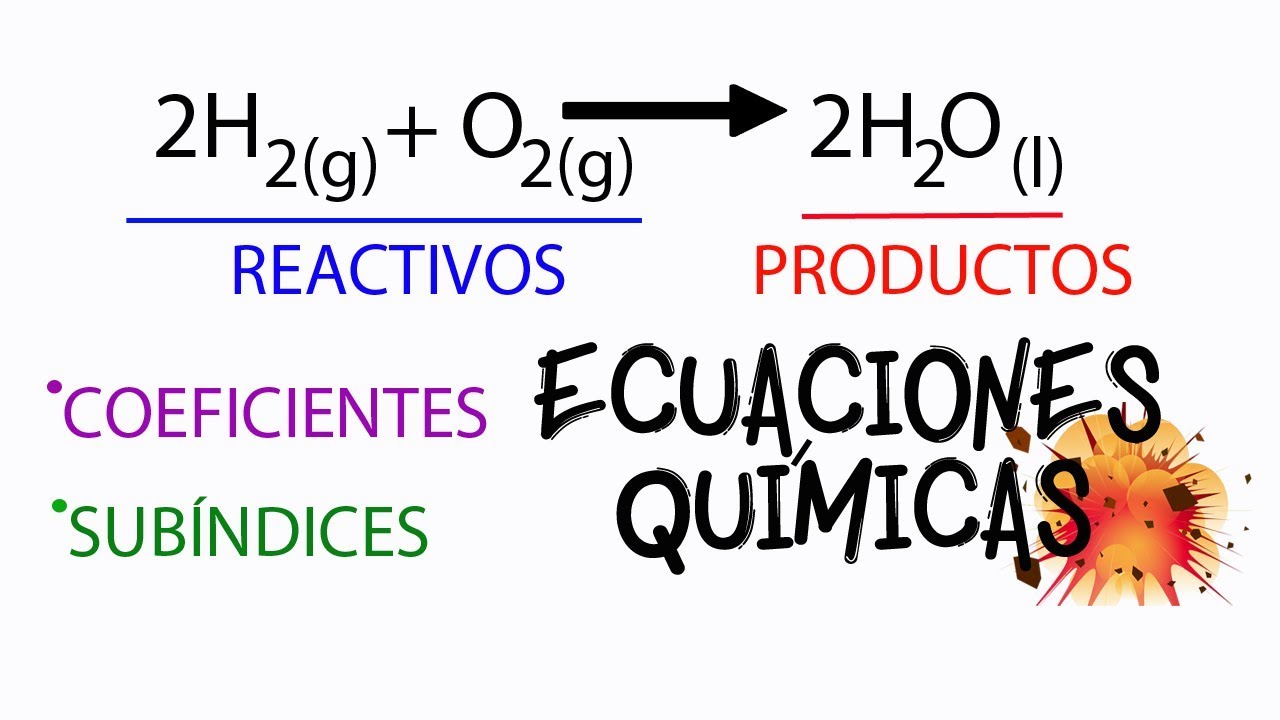
Las ecuaciones químicas son representaciones simbólicas de reacciones químicas. Aprender a leer y escribir estas ecuaciones es esencial para cualquier estudiante de química. En una ecuación química, los reactivos se colocan a la izquierda, mientras que los productos se sitúan a la derecha, separados por una flecha que indica la dirección de la reacción.
Ejemplo de una Ecuación Química
Consideremos la reacción de la formación del agua. La ecuación se puede escribir como:
2 H₂ + O₂ → 2 H₂O
En este caso, el hidrógeno (H₂) y el oxígeno (O₂) son los reactivos, y el agua (H₂O) es el producto. La notación “2 H₂” indica que se necesitan dos moléculas de hidrógeno para reaccionar con una molécula de oxígeno. Esta notación es esencial para balancear la ecuación y asegurar que se cumpla la ley de conservación de la masa.
Balanceo de Ecuaciones
El balanceo de ecuaciones es un paso crucial en la química. Para que una ecuación esté correctamente balanceada, debe haber el mismo número de átomos de cada elemento en ambos lados de la ecuación. Este proceso a menudo implica ajustar los coeficientes que preceden a los compuestos. Por ejemplo, en la ecuación de la formación del agua, ya hemos indicado que se requieren dos moléculas de hidrógeno para reaccionar con una molécula de oxígeno, lo que garantiza que el número de átomos de hidrógeno y oxígeno sea el mismo en ambos lados de la ecuación.
Tipos de Reacciones Químicas y sus Reactivos y Productos
Las reacciones químicas se pueden clasificar en diferentes tipos, y cada tipo tiene características únicas en términos de reactivos y productos. Conocer estos tipos te ayudará a entender mejor cómo se producen las transformaciones químicas.
Reacciones de Síntesis
En las reacciones de síntesis, dos o más reactivos se combinan para formar un solo producto. Un ejemplo común es la formación del cloruro de sodio (NaCl) a partir de sodio (Na) y cloro (Cl₂):
2 Na + Cl₂ → 2 NaCl
En este caso, los reactivos son el sodio y el cloro, y el producto es el cloruro de sodio. Este tipo de reacción es fundamental en la creación de compuestos químicos.
Reacciones de Descomposición
Las reacciones de descomposición son el proceso inverso, donde un solo reactivo se descompone en dos o más productos. Por ejemplo, el carbonato de calcio (CaCO₃) se descompone en óxido de calcio (CaO) y dióxido de carbono (CO₂) cuando se calienta:
CaCO₃ → CaO + CO₂
Este tipo de reacción es común en procesos de descomposición natural y en diversas aplicaciones industriales.
Factores que Afectan las Reacciones Químicas
Existen varios factores que pueden influir en la velocidad y el resultado de las reacciones químicas. Comprender estos factores es esencial para manipular las reacciones en contextos experimentales o industriales.
Concentración de los Reactivos
La concentración de los reactivos es un factor determinante en la velocidad de una reacción. En general, a mayor concentración de reactivos, mayor será la probabilidad de que las moléculas colisionen y reaccionen. Por ejemplo, si se aumenta la concentración de ácido en una reacción de neutralización, la velocidad de reacción también aumentará, produciendo productos más rápidamente.
Temperatura y Presión
La temperatura también juega un papel crucial en las reacciones químicas. A temperaturas más altas, las moléculas tienen más energía cinética, lo que aumenta la frecuencia y la fuerza de las colisiones entre reactivos. Esto puede resultar en una mayor velocidad de reacción. Además, en reacciones que involucran gases, la presión puede afectar el equilibrio y la producción de productos. Por ejemplo, en la síntesis del amoníaco (NH₃), aumentar la presión favorece la formación del producto.
¿Cuál es la diferencia entre reactivos y productos en una reacción química?
Los reactivos son las sustancias que se combinan o transforman durante una reacción química, mientras que los productos son las sustancias que se generan como resultado de esa reacción. La comprensión de esta diferencia es esencial para analizar ecuaciones químicas y entender cómo se producen los cambios en la materia.
¿Por qué es importante balancear las ecuaciones químicas?
El balanceo de ecuaciones químicas es crucial porque asegura que se cumpla la ley de conservación de la masa. Esto significa que la cantidad total de materia antes y después de una reacción debe ser la misma. Un equilibrio adecuado permite predecir la cantidad de productos que se formarán y es fundamental para realizar cálculos estequiométricos.
¿Qué tipos de reacciones químicas existen?
Existen varios tipos de reacciones químicas, incluidas reacciones de síntesis, descomposición, desplazamiento, combustión y redox. Cada tipo tiene características específicas en cuanto a los reactivos y productos involucrados y se comporta de manera diferente en condiciones específicas.
¿Cómo afectan la temperatura y la presión a las reacciones químicas?
La temperatura aumenta la energía cinética de las moléculas, lo que puede acelerar la velocidad de reacción. Por otro lado, en reacciones que involucran gases, la presión puede influir en el equilibrio y la producción de productos. En general, aumentar la temperatura y la presión puede aumentar la velocidad y el rendimiento de las reacciones químicas.
¿Qué es una reacción de neutralización?
Una reacción de neutralización es un tipo específico de reacción química en la que un ácido reacciona con una base para formar agua y un sal. Por ejemplo, cuando el ácido clorhídrico (HCl) reacciona con el hidróxido de sodio (NaOH), se produce agua y cloruro de sodio (NaCl), que es sal de mesa. Estas reacciones son importantes en procesos biológicos y en aplicaciones industriales.
¿Qué papel juegan los catalizadores en las reacciones químicas?
Los catalizadores son sustancias que aceleran la velocidad de una reacción química sin ser consumidos en el proceso. Actúan disminuyendo la energía de activación necesaria para que se produzca la reacción. Esto permite que la reacción ocurra más rápidamente y con menor energía, lo que es especialmente útil en procesos industriales donde se busca eficiencia.
¿Cómo se representan los reactivos y productos en una ecuación química?
En una ecuación química, los reactivos se representan a la izquierda de una flecha, mientras que los productos se encuentran a la derecha. La flecha indica la dirección de la reacción. Además, se utilizan coeficientes para indicar la cantidad de moléculas de cada sustancia que participan en la reacción, asegurando que la ecuación esté balanceada.