La química es una ciencia fascinante que nos ayuda a entender cómo interactúan las sustancias en nuestro entorno. Uno de los conceptos más interesantes es el comportamiento de las sustancias en soluciones acuosas, especialmente aquellas que liberan iones hidrógeno al disolverse en agua. ¿Te has preguntado alguna vez qué tipo de sustancia es aquella que, al disolverse en agua, produce iones hidrógeno? Esta pregunta es fundamental para comprender las propiedades ácidas y básicas de las sustancias. En este artículo, exploraremos en profundidad la naturaleza de estas sustancias, cómo se comportan en solución, sus aplicaciones prácticas y la importancia de los iones hidrógeno en la química. Así que acompáñanos en este recorrido que desvelará los secretos de la química de soluciones acuosas.
Definición de sustancias ácidas
Para entender ¿si una sustancia se disuelve en agua y libera iones hidrógeno, qué tipo de sustancia es?, primero debemos definir qué son las sustancias ácidas. Según la teoría de Arrhenius, una sustancia se clasifica como ácida si, al disolverse en agua, aumenta la concentración de iones hidrógeno (H+). Esta liberación de iones hidrógeno es lo que caracteriza a las soluciones ácidas.
Características de las sustancias ácidas
Las sustancias ácidas tienen varias características distintivas que las diferencian de otros tipos de compuestos. Estas incluyen:
- Sabor agrio: Muchas sustancias ácidas, como el ácido cítrico en los limones, tienen un sabor ácido característico.
- Conductividad eléctrica: Las soluciones ácidas son buenas conductores de electricidad debido a la presencia de iones libres.
- Reacción con metales: Las sustancias ácidas pueden reaccionar con ciertos metales, liberando hidrógeno gaseoso.
Estos rasgos no solo ayudan a identificar sustancias ácidas, sino que también tienen implicaciones prácticas en la vida cotidiana y en la industria. Por ejemplo, el ácido acético en el vinagre es una sustancia comúnmente utilizada en la cocina y la limpieza.
Ejemplos de sustancias ácidas
Existen numerosos ejemplos de sustancias ácidas que se disuelven en agua y liberan iones hidrógeno. Algunos de los más comunes son:
- Ácido clorhídrico (HCl): Utilizado en la limpieza y en procesos industriales.
- Ácido sulfúrico (H2SO4): Usado en baterías y en la fabricación de fertilizantes.
- Ácido acético (CH3COOH): Componente principal del vinagre.
Estos compuestos son fundamentales en diversos procesos químicos y tienen aplicaciones que van desde la cocina hasta la manufactura de productos químicos.
La teoría de Brønsted-Lowry
Además de la teoría de Arrhenius, existe otra perspectiva sobre las sustancias ácidas y básicas que es la teoría de Brønsted-Lowry. Esta teoría amplía la definición de ácidos y bases, considerando no solo la liberación de iones hidrógeno, sino también la capacidad de una sustancia para donar protones (H+).
Ácidos según Brønsted-Lowry
Según la teoría de Brønsted-Lowry, un ácido es cualquier sustancia que puede donar un protón. Esto incluye no solo los ácidos que se disuelven en agua, sino también aquellos que pueden actuar como ácidos en otras soluciones. Por ejemplo, el amoníaco (NH3) puede actuar como una base al aceptar un protón, mientras que el ácido carbónico (H2CO3) puede donar protones en solución acuosa.
Esta perspectiva es especialmente útil en la química orgánica y en reacciones en medios no acuosos, donde la presencia de agua no es un factor determinante. La versatilidad de la teoría de Brønsted-Lowry permite un análisis más profundo de las interacciones químicas.
Ejemplos de reacciones ácido-base
Un buen ejemplo de la teoría de Brønsted-Lowry en acción es la reacción entre el ácido clorhídrico y el amoníaco. En esta reacción, el HCl dona un protón al NH3, formando el ion amonio (NH4+) y el ion cloruro (Cl–).
Otro ejemplo común es la reacción entre el ácido acético y el bicarbonato de sodio (NaHCO3), donde el ácido acético dona un protón al bicarbonato, generando dióxido de carbono (CO2), agua y acetato de sodio.
Propiedades de las soluciones ácidas
Las soluciones que contienen iones hidrógeno presentan propiedades únicas que son esenciales en muchas aplicaciones. Estas propiedades incluyen el pH, la corrosividad y la reactividad.
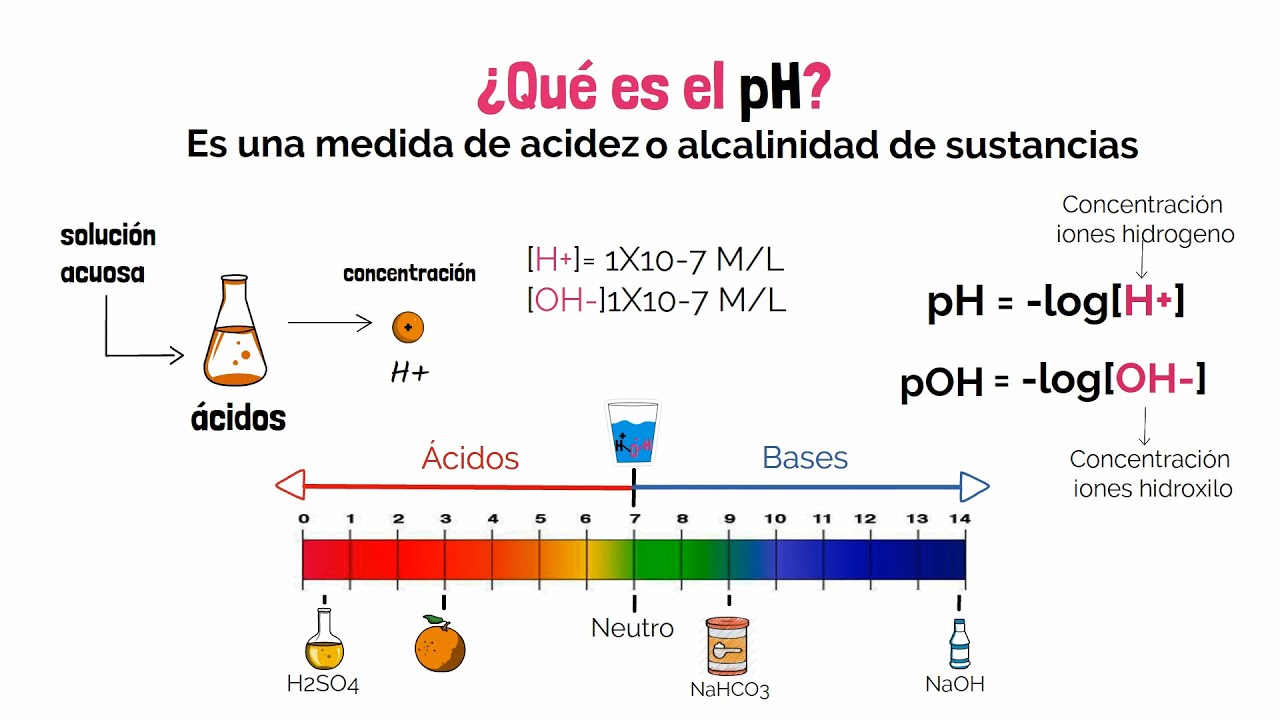
El pH y su importancia
El pH es una medida que indica la acidez o basicidad de una solución. Se utiliza una escala que va de 0 a 14, donde un pH menor a 7 indica una solución ácida. La relación entre el pH y la concentración de iones hidrógeno es inversa: a medida que aumenta la concentración de H+, el pH disminuye. Por ejemplo, una solución de ácido clorhídrico al 0.1 M tendrá un pH de aproximadamente 1, mientras que el agua pura tiene un pH de 7.
El control del pH es crucial en diversas industrias, desde la producción de alimentos hasta la farmacéutica, ya que puede afectar la estabilidad y la efectividad de los productos.
Corrosividad y reactividad
Las soluciones ácidas son generalmente corrosivas y pueden dañar materiales como metales y tejidos orgánicos. Esto se debe a la capacidad de los iones hidrógeno para reaccionar con otras sustancias. Por ejemplo, el ácido sulfúrico puede causar graves quemaduras si entra en contacto con la piel, y puede corroer metales como el hierro y el cobre.
La reactividad de las soluciones ácidas también se observa en su capacidad para participar en reacciones de neutralización con bases. Esta propiedad es utilizada en la fabricación de productos químicos y en el tratamiento de aguas residuales, donde es necesario ajustar el pH para cumplir con las regulaciones ambientales.
Aplicaciones de las sustancias ácidas
Las sustancias que liberan iones hidrógeno tienen numerosas aplicaciones en la vida diaria y en la industria. Desde la cocina hasta la medicina, su presencia es fundamental.
Uso en la industria alimentaria
En la industria alimentaria, los ácidos se utilizan como conservantes y reguladores de pH. Por ejemplo, el ácido cítrico se emplea para acidificar alimentos y bebidas, mejorando su sabor y prolongando su vida útil. Además, el ácido acético es un ingrediente clave en la producción de vinagre, que es utilizado en aderezos y conservas.
Otro ejemplo es el ácido láctico, que se forma durante la fermentación y se utiliza en productos lácteos como el yogur. La regulación del pH en estos productos es crucial para garantizar su seguridad y calidad.
Aplicaciones en la medicina
En medicina, las soluciones ácidas tienen un papel importante en la formulación de medicamentos y tratamientos. Por ejemplo, el ácido acetilsalicílico (aspirina) es un medicamento ampliamente utilizado que actúa como analgésico y antiinflamatorio. La formulación de este tipo de medicamentos requiere un control preciso del pH para asegurar su efectividad y estabilidad.
Además, en la química clínica, se utilizan soluciones ácidas para analizar muestras biológicas, como la sangre, donde el pH puede ser un indicador de la salud del paciente.
Impacto ambiental de las sustancias ácidas
Las sustancias que liberan iones hidrógeno también tienen un impacto significativo en el medio ambiente. La acidificación de los ecosistemas acuáticos es un problema creciente que afecta la biodiversidad y la salud de los hábitats naturales.
Acidificación de los océanos
La acidificación de los océanos es un fenómeno causado por la absorción de dióxido de carbono (CO2) en el agua, lo que lleva a un aumento en la concentración de iones hidrógeno. Este cambio en el pH afecta a organismos marinos, especialmente a los que forman conchas de carbonato de calcio, como los moluscos y corales. La disminución de estas especies puede tener repercusiones en toda la cadena alimentaria marina.
Contaminación del agua
Además, la contaminación industrial puede liberar sustancias ácidas en cuerpos de agua, alterando el pH y afectando la vida acuática. Esto puede resultar en la muerte de peces y otras especies, así como en la pérdida de biodiversidad. La regulación y el tratamiento adecuado de efluentes industriales son cruciales para mitigar estos efectos.
¿Todas las sustancias que liberan iones hidrógeno son ácidas?
No todas las sustancias que liberan iones hidrógeno son consideradas ácidas en todas las condiciones. La clasificación de una sustancia como ácida depende del contexto, como el medio en el que se encuentra y su capacidad para donar protones. La teoría de Brønsted-Lowry, por ejemplo, expande la definición de ácidos más allá de las sustancias que simplemente aumentan la concentración de H+ en agua.
¿Qué es un ácido fuerte y un ácido débil?
Un ácido fuerte es aquel que se ioniza completamente en solución acuosa, liberando todos sus iones hidrógeno. Ejemplos de ácidos fuertes son el ácido clorhídrico y el ácido sulfúrico. Por otro lado, un ácido débil solo se ioniza parcialmente, como el ácido acético. La fuerza de un ácido se mide a través de su constante de disociación ácida (Ka).
¿Cómo se mide el pH de una solución?
El pH de una solución se mide utilizando un pH-metro o tiras reactivas. Un pH-metro es un dispositivo que mide la concentración de iones hidrógeno en una solución y proporciona un valor numérico. Las tiras reactivas cambian de color según el pH de la solución y ofrecen una manera rápida y visual de estimar la acidez o basicidad.
¿Qué sucede si mezclo un ácido con una base?
Cuando se mezclan un ácido y una base, se produce una reacción de neutralización que genera agua y una sal. Por ejemplo, al mezclar ácido clorhídrico con hidróxido de sodio, se forma agua y cloruro de sodio. Esta reacción es fundamental en muchos procesos químicos y en la regulación del pH en diversas aplicaciones.
¿Las sustancias ácidas son peligrosas?
Las sustancias ácidas pueden ser peligrosas si no se manejan adecuadamente. Muchas de ellas son corrosivas y pueden causar quemaduras en la piel o daños en los ojos. Es esencial utilizar equipo de protección personal y seguir protocolos de seguridad al trabajar con estas sustancias, especialmente en entornos industriales o de laboratorio.
¿Cómo afectan las sustancias ácidas a la salud humana?
La exposición a sustancias ácidas puede tener efectos adversos en la salud humana. La inhalación de vapores ácidos puede irritar las vías respiratorias, mientras que el contacto con la piel puede provocar quemaduras. Además, la ingesta accidental de sustancias ácidas puede resultar en lesiones internas graves. Por lo tanto, es fundamental manejar estas sustancias con precaución y en condiciones controladas.