Las reacciones químicas son procesos fascinantes que transforman sustancias en nuevas configuraciones, jugando un papel crucial en nuestra vida diaria y en el funcionamiento del universo. Desde la digestión de los alimentos hasta la fabricación de productos industriales, estas transformaciones dependen de los reactivos y productos que intervienen en cada reacción. Pero, ¿qué son exactamente estos componentes y por qué son tan importantes? En este artículo, exploraremos a fondo la naturaleza de los reactivos y productos en las reacciones químicas, así como su relevancia en diversos campos como la química, la biología y la industria. Aprenderás cómo estos elementos interactúan entre sí y cómo su comprensión puede abrir puertas a innovaciones y soluciones en nuestra vida cotidiana. Acompáñanos en este viaje para descubrir la importancia de los reactivos y productos en las reacciones químicas.
Definición de reactivos y productos
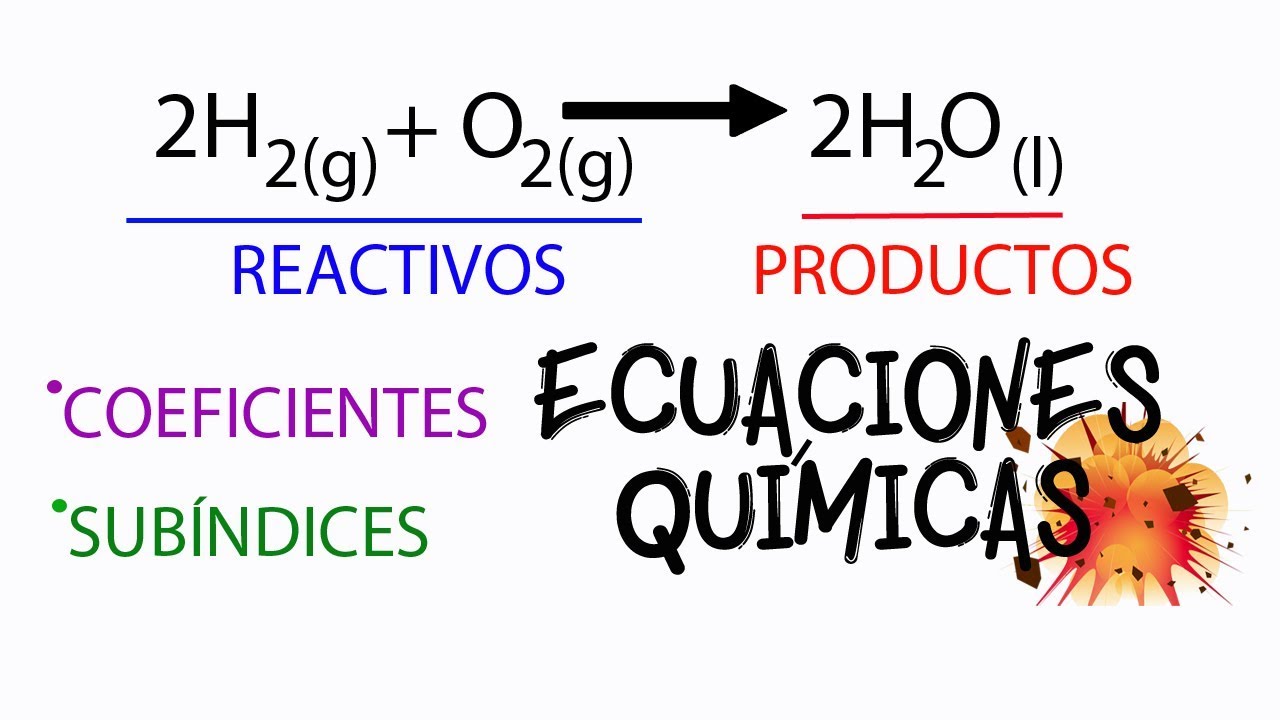
Para entender las reacciones químicas, primero debemos definir qué son los reactivos y productos. Los reactivos son las sustancias que se encuentran al inicio de una reacción, es decir, los materiales que se transforman. Por otro lado, los productos son las sustancias resultantes que se generan al final del proceso. Este concepto es fundamental en la química, ya que cada reacción se puede representar mediante una ecuación química, donde los reactivos se encuentran a la izquierda y los productos a la derecha.
Ejemplo de una reacción química simple
Consideremos la reacción de combustión del metano, un proceso común en la vida diaria. La ecuación química es:
CH₄ + 2 O₂ → CO₂ + 2 H₂O
En este caso, el metano (CH₄) y el oxígeno (O₂) son los reactivos, mientras que el dióxido de carbono (CO₂) y el agua (H₂O) son los productos. Este ejemplo ilustra cómo los reactivos se combinan y transforman en productos a través de un proceso químico.
La importancia de los reactivos y productos en la química
La comprensión de los reactivos y productos es esencial para cualquier estudio químico. Nos permite predecir cómo interactuarán diferentes sustancias, así como entender el equilibrio de las reacciones y cómo se pueden manipular para obtener resultados deseados. Por ejemplo, en la síntesis de medicamentos, conocer los reactivos y productos es crucial para desarrollar compuestos que sean efectivos y seguros para el consumo humano.
Tipos de reacciones químicas y sus componentes
Las reacciones químicas pueden clasificarse en diferentes tipos, y cada una tiene sus propios reactivos y productos característicos. Comprender estos tipos es vital para cualquier estudio en química.
Reacciones de síntesis
En las reacciones de síntesis, dos o más reactivos se combinan para formar un solo producto. Este tipo de reacción es común en la formación de compuestos químicos. Un ejemplo sería la formación del agua a partir de hidrógeno y oxígeno:
2 H₂ + O₂ → 2 H₂O
Aquí, los reactivos son el hidrógeno (H₂) y el oxígeno (O₂), mientras que el producto es el agua (H₂O).
Reacciones de descomposición
Las reacciones de descomposición son el opuesto de las reacciones de síntesis. En este caso, un solo reactivo se descompone en dos o más productos. Un ejemplo común es la descomposición del peróxido de hidrógeno (H₂O₂):
2 H₂O₂ → 2 H₂O + O₂
Aquí, el peróxido de hidrógeno se descompone en agua y oxígeno. Este tipo de reacción es importante en procesos biológicos y en la industria.
Reacciones de desplazamiento
En las reacciones de desplazamiento, un reactivo reemplaza a otro en un compuesto. Un ejemplo clásico es la reacción entre zinc y ácido clorhídrico:
Zn + 2 HCl → ZnCl₂ + H₂
En este caso, el zinc (Zn) desplaza al hidrógeno (H) en el ácido clorhídrico (HCl) para formar cloruro de zinc (ZnCl₂) y gas hidrógeno (H₂).
La ley de conservación de la masa en reacciones químicas
Una de las leyes fundamentales de la química es la ley de conservación de la masa, que establece que en una reacción química, la masa total de los reactivos es igual a la masa total de los productos. Esto significa que los átomos no se crean ni se destruyen, solo se reorganizan.
Implicaciones de la ley de conservación de la masa
Esta ley tiene importantes implicaciones en la química. Por ejemplo, al realizar un experimento, si pesamos los reactivos antes de la reacción y luego pesamos los productos, deberíamos obtener la misma masa. Esto es esencial para el desarrollo de nuevas sustancias y en la industria, donde la precisión en las cantidades es crucial.
Ejemplos prácticos
Un ejemplo práctico de la ley de conservación de la masa se puede observar en la reacción de la fermentación. Cuando la levadura convierte los azúcares en alcohol y dióxido de carbono, la masa total de los reactivos (azúcares) es igual a la masa total de los productos (alcohol y dióxido de carbono). Esto ayuda a los fabricantes de cerveza y vino a calcular las cantidades adecuadas de ingredientes.
Factores que afectan las reacciones químicas
Las reacciones químicas no ocurren de manera arbitraria; hay varios factores que pueden influir en su velocidad y en la cantidad de productos formados. Conocer estos factores es fundamental para controlar y optimizar las reacciones.
Concentración de reactivos
La concentración de los reactivos es un factor crucial. A mayor concentración, generalmente mayor es la probabilidad de que las partículas de los reactivos colisionen y reaccionen. Por ejemplo, en la reacción entre ácido y base, aumentar la concentración del ácido acelerará la neutralización.
Temperatura
La temperatura también juega un papel importante. A temperaturas más altas, las partículas se mueven más rápido, lo que incrementa la energía cinética y, por ende, la frecuencia de colisiones efectivas. Esto es evidente en procesos como la cocción de alimentos, donde el calor acelera las reacciones químicas que transforman los ingredientes.
Catalizadores
Los catalizadores son sustancias que aumentan la velocidad de una reacción sin consumirse en el proceso. Por ejemplo, en la fabricación de amoníaco, se utilizan catalizadores para facilitar la reacción entre el hidrógeno y el nitrógeno, lo que permite obtener el producto deseado más rápidamente y a temperaturas más bajas.
La importancia de los reactivos y productos en la industria
La comprensión de los reactivos y productos no solo es fundamental en la teoría química, sino que también tiene aplicaciones prácticas en la industria. Desde la fabricación de productos farmacéuticos hasta la producción de energía, los reactivos y productos son esenciales en múltiples procesos.
Productos farmacéuticos
En la industria farmacéutica, conocer los reactivos y productos es crucial para el desarrollo de medicamentos. Por ejemplo, durante la síntesis de un nuevo fármaco, los químicos deben identificar los reactivos adecuados que generarán los productos deseados, asegurándose de que estos sean efectivos y seguros para los pacientes.
Energía y combustibles
En la producción de energía, la comprensión de las reacciones de combustión es esencial. Los combustibles fósiles, como el petróleo y el gas natural, se queman en presencia de oxígeno para producir energía, agua y dióxido de carbono. Conocer los reactivos y productos en estas reacciones ayuda a optimizar la eficiencia y a desarrollar tecnologías más limpias.
Química ambiental
En el ámbito de la química ambiental, el conocimiento de los reactivos y productos es vital para abordar problemas como la contaminación. Por ejemplo, en el tratamiento de aguas residuales, se utilizan reactivos para eliminar contaminantes, y es esencial entender qué productos se generan para evaluar la eficacia del proceso.
La comprensión de los reactivos y productos en las reacciones químicas es fundamental para cualquier persona interesada en la química, ya que proporciona una base sólida para el estudio de procesos químicos complejos. Desde la investigación científica hasta la industria, estos conceptos son esenciales para el desarrollo y la innovación. Conocer cómo interactúan los reactivos y productos nos permite no solo predecir resultados, sino también diseñar procesos más eficientes y sostenibles.
¿Qué son los reactivos en una reacción química?
Los reactivos son las sustancias que se combinan al inicio de una reacción química. Son los materiales que sufren transformaciones durante el proceso. Por ejemplo, en la reacción de combustión del metano, el metano y el oxígeno son los reactivos que se transforman en productos como el dióxido de carbono y el agua.
¿Por qué son importantes los productos de una reacción química?
Los productos son las sustancias resultantes de una reacción química. Su importancia radica en que determinan el resultado final del proceso químico. En la industria, los productos son lo que se comercializa, y entender su formación es crucial para optimizar procesos y garantizar la calidad.
¿Cómo afecta la temperatura a las reacciones químicas?
La temperatura afecta la velocidad de las reacciones químicas. A temperaturas más altas, las partículas se mueven más rápido, lo que incrementa la frecuencia de colisiones efectivas entre los reactivos. Esto puede resultar en una reacción más rápida y, en algunos casos, en una mayor cantidad de productos generados.
¿Qué es un catalizador y cómo funciona?
Un catalizador es una sustancia que acelera una reacción química sin ser consumida en el proceso. Funciona al proporcionar un camino alternativo para la reacción, que requiere menos energía. Esto permite que las reacciones ocurran más rápidamente y a temperaturas más bajas, lo que es esencial en muchos procesos industriales.
¿Cómo se representan las reacciones químicas?
Las reacciones químicas se representan mediante ecuaciones químicas, donde los reactivos se colocan a la izquierda y los productos a la derecha. Por ejemplo, en la reacción de formación de agua, la ecuación es 2 H₂ + O₂ → 2 H₂O, donde los reactivos son el hidrógeno y el oxígeno, y el producto es el agua.
¿Qué es la ley de conservación de la masa?
La ley de conservación de la masa establece que en una reacción química, la masa total de los reactivos es igual a la masa total de los productos. Esto significa que los átomos no se crean ni se destruyen, solo se reorganizan. Es un principio fundamental que guía el estudio de las reacciones químicas.
¿Cuáles son algunos ejemplos de reacciones químicas en la vida diaria?
Existen muchos ejemplos de reacciones químicas en la vida diaria, como la digestión de alimentos, la cocción de ingredientes, la fermentación en la elaboración de pan y bebidas alcohólicas, y la combustión de combustibles en vehículos. Cada uno de estos procesos implica la transformación de reactivos en productos, demostrando la omnipresencia de la química en nuestras vidas.