La química y la física nos ofrecen un sinfín de conceptos fascinantes, y uno de los más intrigantes es la capacidad de un material para disolverse en otro. Este fenómeno, conocido como solubilidad, juega un papel crucial en diversas aplicaciones, desde la medicina hasta la cocina. ¿Alguna vez te has preguntado por qué la sal se disuelve en agua, pero no en aceite? A lo largo de este artículo, exploraremos en profundidad qué significa realmente la solubilidad, cómo se mide, y los factores que influyen en este proceso. Si quieres entender mejor este concepto y su importancia en el mundo que nos rodea, sigue leyendo para descubrirlo.
¿Qué es la solubilidad?
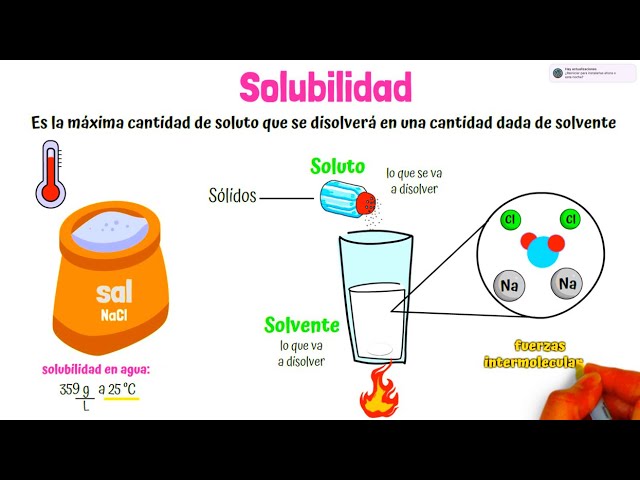
La solubilidad se define como la capacidad de una sustancia, llamada soluto, para disolverse en otra sustancia, conocida como disolvente, formando una solución homogénea. Este proceso es fundamental en la química, ya que permite la interacción entre diferentes compuestos. La solubilidad no es un concepto estático; varía dependiendo de varios factores, incluyendo la temperatura, la presión y la naturaleza química de las sustancias involucradas.
Definición de términos clave
Para entender mejor la solubilidad, es útil conocer algunos términos clave:
- Soluto: Es la sustancia que se disuelve. Por ejemplo, en una solución de sal en agua, la sal es el soluto.
- Disolvente: Es la sustancia en la que se disuelve el soluto. En el ejemplo anterior, el agua es el disolvente.
- Solución: Es el resultado de la mezcla del soluto y el disolvente, donde ambos se combinan para formar una fase única.
Tipos de solubilidad
Existen diferentes tipos de solubilidad, que se pueden clasificar según el estado físico de los componentes involucrados:
- Solubilidad sólida: Ocurre cuando un sólido se disuelve en un líquido, como la sal en agua.
- Solubilidad líquida: Se refiere a la capacidad de un líquido para disolverse en otro líquido, como el alcohol en agua.
- Solubilidad gaseosa: Se refiere a la disolución de un gas en un líquido, como el dióxido de carbono en agua.
Factores que influyen en la solubilidad
La solubilidad no es un fenómeno simple; varios factores pueden influir en la capacidad de un material para disolverse en otro. Comprender estos factores es crucial para aplicaciones prácticas en la ciencia y la industria.
Temperatura
La temperatura es uno de los factores más importantes que afectan la solubilidad. En general, para sólidos en líquidos, un aumento de temperatura suele aumentar la solubilidad. Por ejemplo, el azúcar se disuelve más fácilmente en agua caliente que en agua fría. Sin embargo, este patrón no siempre se aplica a los gases, cuya solubilidad en líquidos tiende a disminuir con el aumento de temperatura. Esto se debe a que el calor proporciona energía suficiente para que las moléculas de gas escapen del líquido.
Presión
La presión tiene un efecto significativo en la solubilidad de los gases. Según la ley de Henry, la solubilidad de un gas en un líquido es directamente proporcional a la presión parcial del gas sobre el líquido. Esto significa que al aumentar la presión, más gas se disolverá en el líquido. Un ejemplo cotidiano de esto es la soda; cuando la lata está sellada, la presión mantiene el dióxido de carbono disuelto. Al abrirla, la presión disminuye y el gas escapa, formando burbujas.
Polaridad de las sustancias
La polaridad es otro factor crucial en la solubilidad. Las sustancias polares, como el agua, tienden a disolver solutos polares (como la sal), mientras que las sustancias no polares (como el aceite) son más efectivas en disolver solutos no polares (como la grasa). Este principio se resume en la frase «lo similar disuelve lo similar». Esto es esencial en aplicaciones como la formulación de productos químicos y farmacéuticos, donde la elección del disolvente adecuado puede afectar la eficacia del producto final.
Medición de la solubilidad
La solubilidad se mide comúnmente en términos de concentración, que puede expresarse de diversas maneras. Entender cómo se mide la solubilidad es vital para su aplicación en la industria y la investigación.
Unidades de solubilidad
La solubilidad se puede expresar en diferentes unidades, dependiendo del contexto. Las más comunes incluyen:
- Gramos por litro (g/L): Es una medida directa de la cantidad de soluto que se puede disolver en un litro de disolvente.
- Molalidad (mol/kg): Es la cantidad de soluto en moles disuelto en un kilogramo de disolvente.
- Porcentaje en masa (%): Indica la masa del soluto en relación a la masa total de la solución.
Curvas de solubilidad
Las curvas de solubilidad son gráficas que muestran cómo varía la solubilidad de un soluto con la temperatura. Estas curvas son herramientas útiles en laboratorios y procesos industriales, ya que permiten a los científicos predecir cómo se comportará un soluto en diferentes condiciones. Por ejemplo, una curva puede mostrar que a 25°C, un soluto tiene una solubilidad de 10 g/100 mL, pero a 50°C, esta solubilidad puede aumentar a 20 g/100 mL.
Ejemplos de solubilidad en la vida cotidiana
La solubilidad es un fenómeno que encontramos en muchos aspectos de nuestra vida diaria. Desde la cocina hasta la medicina, entender cómo y por qué ciertos materiales se disuelven en otros es fundamental.
Cocina y gastronomía
En la cocina, la solubilidad juega un papel crucial en la preparación de alimentos. Por ejemplo, al hacer una infusión de té, el agua caliente actúa como disolvente, extrayendo compuestos aromáticos y sabores de las hojas de té. Asimismo, al disolver azúcar en agua para preparar jarabes o bebidas, la temperatura y la agitación son factores que pueden acelerar el proceso de disolución.
Medicina y farmacología
En el ámbito médico, la solubilidad es esencial para la formulación de medicamentos. Los fármacos deben ser solubles en el cuerpo humano para ser eficaces. Por ejemplo, los medicamentos en forma de tabletas deben disolverse en el tracto digestivo para que los principios activos sean absorbidos por el organismo. Además, la solubilidad de los medicamentos puede influir en su biodisponibilidad, es decir, la cantidad que llega a la circulación sistémica y está disponible para tener un efecto terapéutico.
Impacto ambiental y solubilidad
La solubilidad también tiene un impacto significativo en el medio ambiente, especialmente en la forma en que los contaminantes se comportan en el agua y el suelo. Comprender la solubilidad de diferentes sustancias es clave para abordar problemas de contaminación y desarrollar estrategias de remediación efectivas.
Contaminantes en el agua
Los contaminantes solubles en agua, como ciertos productos químicos industriales, pueden ser transportados a través de cuerpos de agua, afectando la vida acuática y la calidad del agua. La solubilidad de un contaminante puede determinar su toxicidad y su capacidad para ser absorbido por organismos acuáticos. Por ejemplo, el mercurio, que tiene una baja solubilidad en agua, puede acumularse en los tejidos de los peces, presentando un riesgo para la salud humana al ser consumidos.
Remediación de suelos contaminados
La remediación de suelos contaminados a menudo implica el uso de disolventes para extraer contaminantes. Comprender la solubilidad de los contaminantes en diferentes condiciones de humedad y temperatura es fundamental para desarrollar métodos efectivos de limpieza. Por ejemplo, en suelos contaminados con hidrocarburos, se pueden utilizar agentes quelantes que aumenten la solubilidad de los contaminantes, facilitando su extracción.
¿Qué factores afectan la solubilidad de un soluto?
La solubilidad de un soluto puede verse afectada por varios factores, incluyendo la temperatura, la presión y la polaridad de las sustancias involucradas. Por ejemplo, en general, el aumento de temperatura aumenta la solubilidad de los sólidos, pero puede disminuir la solubilidad de los gases. La polaridad también juega un papel crucial, ya que «lo similar disuelve lo similar».
¿Por qué la sal se disuelve en agua pero no en aceite?
La sal es un compuesto iónico y altamente polar, lo que significa que se disuelve bien en disolventes polares como el agua. El aceite, por otro lado, es no polar y no puede interactuar con los iones de la sal, por lo que la sal no se disolverá en aceite. Este principio es fundamental en la cocina y la formulación de productos químicos.
¿Cómo se mide la solubilidad de un compuesto?
La solubilidad se mide en términos de concentración, que puede expresarse en unidades como gramos por litro (g/L), molalidad (mol/kg) o porcentaje en masa. Las curvas de solubilidad también se utilizan para visualizar cómo cambia la solubilidad de un soluto con la temperatura, lo que es útil en laboratorios y procesos industriales.
¿Qué es la solubilidad en equilibrio?
La solubilidad en equilibrio se refiere al estado en el que la cantidad de soluto que se disuelve en el disolvente es igual a la cantidad que se precipita. En este estado, no hay un cambio neto en la concentración de soluto en la solución. Este concepto es fundamental en química para entender las reacciones reversibles y los procesos de disolución.
¿Por qué es importante la solubilidad en la industria farmacéutica?
La solubilidad es crucial en la industria farmacéutica porque afecta la biodisponibilidad de los medicamentos. Un fármaco debe ser soluble para ser absorbido eficazmente en el cuerpo. La formulación de medicamentos a menudo implica ajustar la solubilidad para garantizar que el principio activo se disuelva adecuadamente en el tracto digestivo y alcance la circulación sistémica.
¿La solubilidad cambia con la presión?
Sí, la solubilidad de los gases en líquidos cambia con la presión. Según la ley de Henry, la solubilidad de un gas es directamente proporcional a su presión parcial sobre el líquido. Esto significa que al aumentar la presión, más gas se disolverá en el líquido. Este principio se aplica en diversas aplicaciones, como la carbonatación de bebidas.
¿Qué sucede cuando un soluto alcanza su límite de solubilidad?
Cuando un soluto alcanza su límite de solubilidad, cualquier cantidad adicional de soluto no se disolverá y, en su lugar, se precipitará o quedará en forma de partículas sólidas en el fondo del recipiente. Este fenómeno es importante en procesos químicos y en la formulación de soluciones, ya que determina la concentración máxima de soluto que puede ser alcanzada en un disolvente dado.