Las proteínas son macromoléculas esenciales que desempeñan roles cruciales en prácticamente todos los procesos biológicos. Desde la construcción de tejidos hasta la regulación de reacciones químicas, su importancia es indiscutible. Sin embargo, para entender cómo funcionan las proteínas, es fundamental conocer sus características estructurales. Este artículo explora las diferentes facetas de la estructura de las proteínas, desde su composición química hasta su plegamiento y función. Además, se abordarán conceptos como la estructura primaria, secundaria, terciaria y cuaternaria, así como su relación con la funcionalidad. Si deseas profundizar en el fascinante mundo de las proteínas, aquí encontrarás información valiosa y detallada que te ayudará a apreciar la complejidad de estas moléculas vitales.
Estructura Primaria: La Secuencia de Aminoácidos
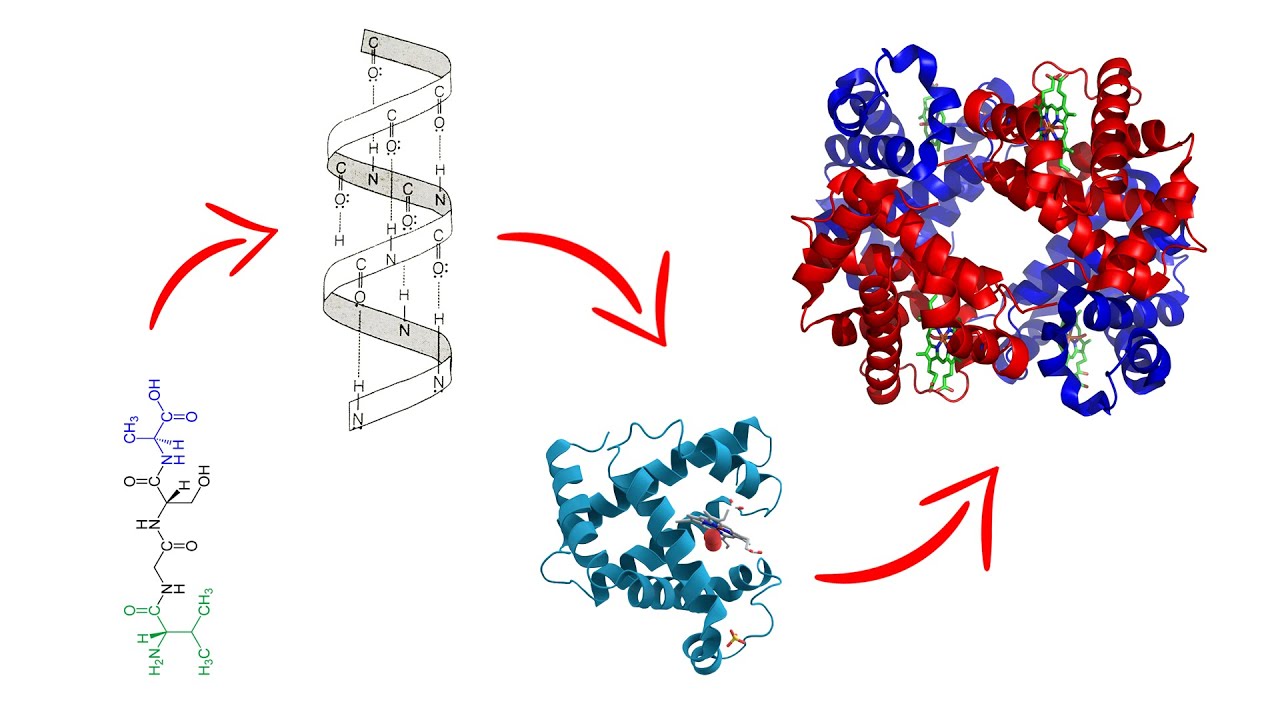
La estructura primaria de una proteína se refiere a la secuencia lineal de aminoácidos que la componen. Esta secuencia es única para cada proteína y determina su identidad y función. Los aminoácidos se enlazan entre sí mediante enlaces peptídicos, formando una cadena que puede variar en longitud y composición. La secuencia de aminoácidos es fundamental porque pequeños cambios pueden tener un impacto significativo en la estructura y función de la proteína.
Importancia de la Secuencia de Aminoácidos
La secuencia de aminoácidos en la estructura primaria no solo define la identidad de una proteína, sino que también influye en cómo se pliega en estructuras más complejas. Por ejemplo, una sola mutación en la secuencia puede dar lugar a enfermedades genéticas como la fibrosis quística, donde una proteína que normalmente regula el transporte de iones se pliega incorrectamente debido a un cambio en un aminoácido. Esto resalta la importancia de la precisión en la secuencia de aminoácidos.
Además, la estructura primaria es clave para el desarrollo de fármacos. Los científicos pueden diseñar medicamentos que se dirigen a proteínas específicas basándose en su secuencia de aminoácidos. Por lo tanto, comprender la estructura primaria es un primer paso crítico en la biología molecular y la biotecnología.
Ejemplos de Estructura Primaria
Un ejemplo clásico de estructura primaria es la insulina, una hormona que regula el azúcar en la sangre. La insulina está compuesta por 51 aminoácidos dispuestos en dos cadenas. La secuencia de estos aminoácidos es esencial para su función como regulador del metabolismo de la glucosa. Otro ejemplo es la hemoglobina, que transporta oxígeno en la sangre y tiene una secuencia de aminoácidos que le permite unirse al oxígeno de manera eficiente.
Estructura Secundaria: Plegados Locales
La estructura secundaria se refiere a los patrones de plegamiento que ocurren en segmentos de la cadena polipeptídica. Los dos tipos más comunes de estructuras secundarias son la hélice alfa y la hoja beta. Estas estructuras son estabilizadas por enlaces de hidrógeno que se forman entre los átomos de oxígeno y nitrógeno de los enlaces peptídicos.
Hélice Alfa y Hoja Beta
La hélice alfa es una estructura en espiral que permite un empaquetamiento eficiente de la cadena de aminoácidos. Por otro lado, la hoja beta se forma cuando segmentos de la cadena se alinean lado a lado, creando una estructura plana y en forma de acordeón. Ambas estructuras son fundamentales para la estabilidad de la proteína y afectan su función. Por ejemplo, las proteínas fibrosas como el colágeno presentan una alta proporción de hélices alfa, lo que les proporciona resistencia y elasticidad.
Impacto en la Función
La estructura secundaria no solo es importante para la estabilidad, sino que también influye en la funcionalidad de las proteínas. Por ejemplo, las enzimas, que son proteínas que catalizan reacciones químicas, a menudo tienen una combinación de hélices alfa y hojas beta que crean un sitio activo específico. Este sitio es donde se unen los sustratos, y su forma depende de la disposición de las estructuras secundarias. Sin una correcta conformación secundaria, la actividad enzimática se vería comprometida.
Estructura Terciaria: El Plegado Global
La estructura terciaria es el resultado del plegamiento tridimensional de la cadena polipeptídica completa. Este plegado es crucial porque determina la funcionalidad de la proteína. La estructura terciaria se estabiliza a través de diversas interacciones, incluyendo enlaces iónicos, interacciones hidrofóbicas y enlaces de hidrógeno. La combinación de estas interacciones permite que la proteína adopte su forma final y funcional.
Interacciones en la Estructura Terciaria
Las interacciones que estabilizan la estructura terciaria son variadas y complejas. Las interacciones hidrofóbicas, por ejemplo, tienden a ocurrir entre aminoácidos no polares que se agrupan en el interior de la proteína, alejándose del agua. En contraste, los aminoácidos polares y cargados se orientan hacia el exterior, donde pueden interactuar con el entorno acuoso. Estas interacciones son cruciales para la estabilidad de la proteína en condiciones biológicas.
Ejemplos de Estructura Terciaria
Un ejemplo de estructura terciaria es la mioglobina, que almacena oxígeno en los músculos. Su estructura terciaria le permite unirse al oxígeno de manera eficiente, facilitando su liberación cuando es necesario. Otro ejemplo es la enzima lactasa, que descompone la lactosa en glucosa y galactosa. La forma específica de la lactasa permite que se una a su sustrato, mostrando cómo la estructura terciaria influye en la función.
Estructura Cuaternaria: La Unión de Subunidades
La estructura cuaternaria se refiere a la organización de múltiples cadenas polipeptídicas en una sola proteína funcional. No todas las proteínas tienen esta estructura, pero aquellas que sí lo hacen, como la hemoglobina, son ejemplos destacados de cómo las subunidades pueden interactuar para formar una función completa. La hemoglobina, por ejemplo, está compuesta por cuatro subunidades, lo que le permite transportar oxígeno de manera eficiente.
Ejemplos de Estructura Cuaternaria
Un caso notable de estructura cuaternaria es el colágeno, que está formado por tres cadenas de polipéptidos que se entrelazan. Esta disposición le otorga una gran resistencia y es fundamental en tejidos como la piel, huesos y cartílagos. Otro ejemplo es el complejo de la ATP sintasa, que consiste en múltiples subunidades que trabajan juntas para sintetizar ATP, la moneda energética de las células.
Relevancia Funcional de la Estructura Cuaternaria
La estructura cuaternaria es esencial para la funcionalidad de muchas proteínas. La cooperación entre subunidades puede aumentar la eficiencia de las reacciones, como se observa en la hemoglobina, donde la unión de oxígeno a una subunidad facilita la unión en las demás. Este fenómeno se conoce como cooperatividad, y es crucial para la regulación de procesos biológicos.
Factores que Afectan la Estructura de las Proteínas
La estructura de las proteínas puede verse afectada por diversos factores ambientales, como el pH, la temperatura y la concentración de sales. Estos factores pueden inducir desnaturalización, un proceso donde la proteína pierde su estructura y, por ende, su funcionalidad. Entender estos factores es esencial para la biología molecular y la biotecnología, ya que muchas aplicaciones dependen de la estabilidad de las proteínas.
Desnaturalización y sus Consecuencias
La desnaturalización puede ser reversible o irreversible, dependiendo de la severidad del cambio en las condiciones. Por ejemplo, el calentamiento de una proteína puede causar que se desnaturalice, pero si se enfría a la temperatura adecuada, puede volver a adoptar su forma original. Sin embargo, en algunos casos, como en la coagulación de las proteínas en la clara de huevo al cocinar, la desnaturalización es irreversible. Esto resalta la importancia de las condiciones ambientales en la función proteica.
Aplicaciones Prácticas y Biotecnología
La comprensión de cómo los factores afectan la estructura de las proteínas tiene aplicaciones prácticas en la biotecnología y la medicina. Por ejemplo, en la industria farmacéutica, se diseñan fármacos que deben ser estables a diferentes condiciones. La ingeniería de proteínas también se utiliza para crear enzimas que funcionen en condiciones extremas, como las altas temperaturas en procesos industriales. Estos avances dependen de un conocimiento profundo de las características estructurales de las proteínas.
¿Qué son las proteínas y por qué son importantes?
Las proteínas son macromoléculas formadas por cadenas de aminoácidos y son esenciales para diversas funciones biológicas. Participan en la construcción de tejidos, la regulación de procesos metabólicos y la defensa del organismo. Sin proteínas, los procesos vitales no podrían llevarse a cabo.
¿Cómo se determina la función de una proteína?
La función de una proteína está determinada en gran medida por su estructura. La secuencia de aminoácidos, el plegamiento y la forma tridimensional influyen en cómo interactúa con otras moléculas. Por ejemplo, la forma de una enzima debe coincidir con su sustrato para que pueda catalizar una reacción.
¿Qué es la desnaturalización de proteínas?
La desnaturalización es el proceso mediante el cual una proteína pierde su estructura tridimensional y, por lo tanto, su funcionalidad. Esto puede ser causado por cambios en el pH, la temperatura o la concentración de sales. La desnaturalización puede ser reversible o irreversible, dependiendo de las condiciones.
¿Qué son las enzimas y cómo se relacionan con las proteínas?
Las enzimas son un tipo de proteína que actúa como catalizador en reacciones químicas, acelerando su velocidad sin ser consumidas en el proceso. La estructura de las enzimas es crucial para su actividad, ya que su sitio activo debe encajar perfectamente con el sustrato para facilitar la reacción.
¿Por qué es importante el estudio de las proteínas en la biotecnología?
El estudio de las proteínas es fundamental en biotecnología porque permite el diseño de nuevos fármacos, la creación de enzimas específicas para procesos industriales y el desarrollo de tratamientos para enfermedades. La ingeniería de proteínas puede conducir a avances significativos en la medicina y la producción de alimentos.
¿Cómo afecta la temperatura a la estructura de las proteínas?
La temperatura puede afectar la estructura de las proteínas al influir en las interacciones que mantienen su forma. A temperaturas elevadas, las proteínas pueden desnaturalizarse, perdiendo su funcionalidad. Por otro lado, temperaturas muy bajas pueden ralentizar las reacciones enzimáticas, afectando la actividad biológica.
¿Qué papel juegan las proteínas en la dieta humana?
Las proteínas son un componente esencial de la dieta humana, ya que son necesarias para el crecimiento y la reparación de tejidos. Además, las proteínas en la dieta se descomponen en aminoácidos, que son utilizados por el cuerpo para sintetizar nuevas proteínas según sea necesario. Una ingesta adecuada de proteínas es vital para mantener la salud y el bienestar.