Cuando hablamos de química, uno de los conceptos fundamentales que debemos entender es el número de masa de un elemento químico. Este valor no solo es crucial para la comprensión de la estructura atómica, sino que también juega un papel importante en la determinación de las propiedades físicas y químicas de los elementos. Si alguna vez te has preguntado cómo se calcula el número de masa, estás en el lugar correcto. En esta guía, exploraremos los pasos necesarios para obtener el número de masa de un elemento, así como la importancia de este número en el contexto de la química moderna. A lo largo del artículo, te proporcionaremos ejemplos claros y prácticos para que puedas aplicar lo aprendido. Prepárate para sumergirte en el fascinante mundo de la química y descubrir cómo sacar el número de masa de un elemento químico.
¿Qué es el Número de Masa?
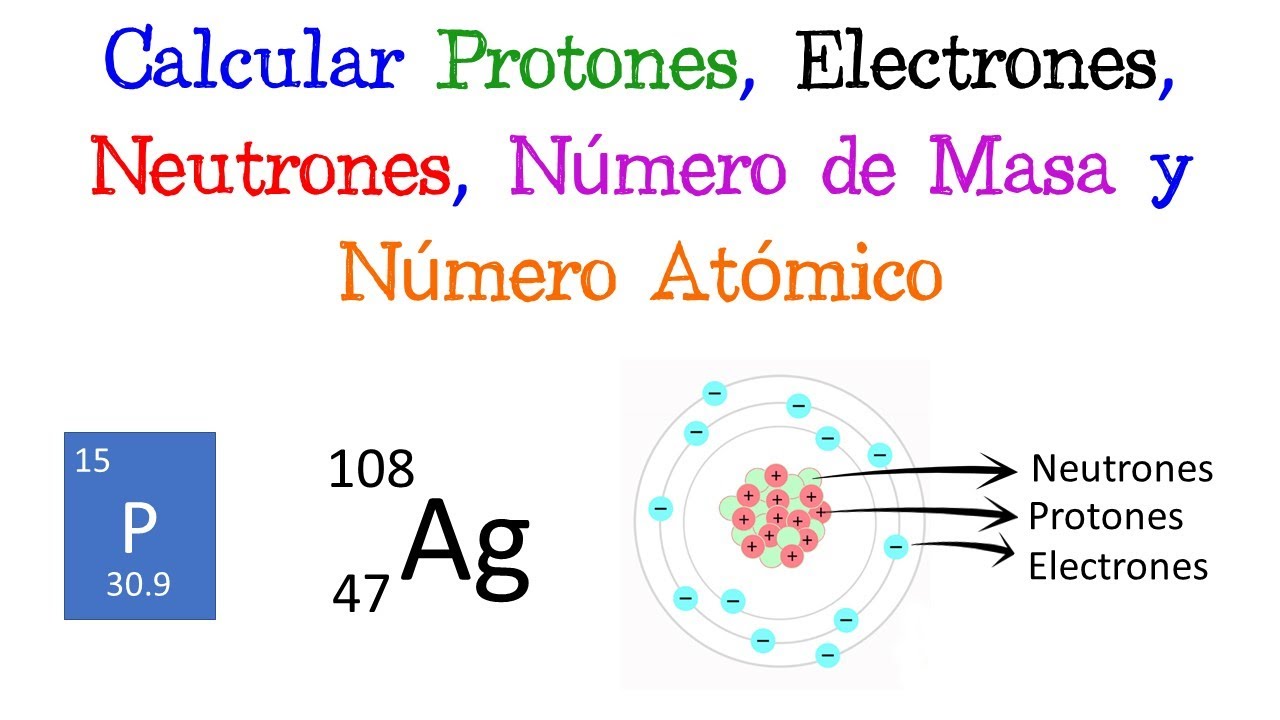
El número de masa es una propiedad fundamental de los átomos, que representa la suma de protones y neutrones en el núcleo de un átomo. Este número es esencial para identificar un elemento y para entender su comportamiento en reacciones químicas. Cada elemento químico tiene un número atómico, que indica la cantidad de protones, y el número de masa complementa esta información al incluir los neutrones. La relación entre estos dos números es crucial para comprender la estabilidad y las características isotópicas de un elemento.
Protones y Neutrones
Para entender cómo se calcula el número de masa, primero debemos definir qué son los protones y neutrones. Los protones son partículas subatómicas con carga positiva, y su número determina la identidad del elemento. Por ejemplo, el hidrógeno tiene un protón, mientras que el carbono tiene seis. Por otro lado, los neutrones no tienen carga y su número puede variar en átomos del mismo elemento, formando así diferentes isótopos.
La fórmula básica para calcular el número de masa es sencilla: simplemente sumamos el número de protones (Z) y el número de neutrones (N). Esto se expresa como:
Número de masa (A) = Z (protones) + N (neutrones)
Importancia del Número de Masa
El número de masa no solo es un número que aparece en la tabla periódica; tiene implicaciones prácticas en la química y la física. Por ejemplo, el número de masa ayuda a los científicos a predecir cómo se comportarán los átomos en reacciones químicas. También es fundamental en la identificación de isótopos, que son átomos del mismo elemento con diferentes números de neutrones. Estos isótopos pueden tener aplicaciones en medicina, como en la terapia de radiación y en técnicas de datación.
Cómo Encontrar el Número de Masa en la Tabla Periódica
La tabla periódica es una herramienta esencial para cualquier estudiante de química. En ella, cada elemento tiene su propio recuadro que incluye información clave, como el símbolo químico, el número atómico y el número de masa. Para encontrar el número de masa de un elemento, sigue estos pasos:
- Localiza el elemento: Busca el símbolo químico del elemento en la tabla periódica.
- Identifica el número atómico: Este número, que se encuentra generalmente en la parte superior del recuadro, indica la cantidad de protones.
- Encuentra el número de masa: El número de masa se muestra como un número entero o decimal en la parte inferior del recuadro. Este valor representa la media ponderada de los isótopos del elemento, teniendo en cuenta su abundancia natural.
Por ejemplo, el carbono tiene un número atómico de 6 y un número de masa de aproximadamente 12.01. Esto significa que la mayoría de los átomos de carbono tienen 6 protones y aproximadamente 6 neutrones, aunque hay isótopos de carbono que tienen más neutrones.
Calculando el Número de Masa: Ejemplo Práctico
Veamos un ejemplo práctico para calcular el número de masa. Supongamos que queremos encontrar el número de masa del oxígeno, que tiene un número atómico de 8. La mayoría de los átomos de oxígeno tienen 8 protones. Sin embargo, el número de neutrones puede variar. En la naturaleza, el oxígeno tiene tres isótopos principales: oxígeno-16, oxígeno-17 y oxígeno-18.
Isótopos del Oxígeno
Los isótopos del oxígeno son los siguientes:
- Oxígeno-16: 8 protones y 8 neutrones (8 + 8 = 16)
- Oxígeno-17: 8 protones y 9 neutrones (8 + 9 = 17)
- Oxígeno-18: 8 protones y 10 neutrones (8 + 10 = 18)
En la tabla periódica, el número de masa del oxígeno se presenta como 16.00. Esto se debe a que se utiliza la media ponderada de los isótopos en función de su abundancia natural. Por lo tanto, aunque la mayoría de los átomos de oxígeno son oxígeno-16, hay una pequeña cantidad de oxígeno-17 y oxígeno-18 presentes en la naturaleza.
Factores que Afectan el Número de Masa
Es importante mencionar que el número de masa puede verse afectado por varios factores, como la presencia de isótopos y la abundancia de cada uno. La existencia de isótopos es un fenómeno común en la naturaleza. Un isótopo es una variante de un elemento que tiene el mismo número de protones pero diferente número de neutrones. Esto significa que aunque el elemento sea el mismo, su número de masa puede variar.
Abundancia Isotópica
La abundancia isotópica se refiere a la proporción en la que se encuentran los isótopos de un elemento en la naturaleza. Por ejemplo, el cloro tiene dos isótopos principales: cloro-35 y cloro-37. La mayoría de los átomos de cloro son cloro-35, pero una pequeña proporción es cloro-37. Esto afecta el número de masa promedio que se muestra en la tabla periódica.
Para calcular el número de masa promedio, se utiliza la siguiente fórmula:
Número de masa promedio = (abundancia del isótopo 1 x masa del isótopo 1) + (abundancia del isótopo 2 x masa del isótopo 2)
Si tomamos el cloro como ejemplo, si el 75% de los átomos son cloro-35 y el 25% son cloro-37, el número de masa promedio se calcularía de la siguiente manera:
Número de masa promedio = (0.75 x 35) + (0.25 x 37) = 35.5
El Impacto de la Radioactividad
La radioactividad también puede influir en el número de masa de ciertos elementos. Los isótopos radiactivos tienen un número de masa que puede cambiar con el tiempo debido a la descomposición. Este fenómeno es importante en aplicaciones como la datación por radiocarbono, donde se mide la cantidad de isótopos radiactivos en un material para determinar su edad.
¿El número de masa es el mismo que el número atómico?
No, el número de masa y el número atómico son diferentes. El número atómico indica la cantidad de protones en un átomo, mientras que el número de masa es la suma de protones y neutrones. Por lo tanto, el número de masa es siempre un número entero, mientras que el número atómico puede ser un número entero o decimal en el caso de elementos con isótopos.
¿Cómo se utilizan los isótopos en la medicina?
Los isótopos se utilizan en medicina para diagnósticos y tratamientos. Por ejemplo, el isótopo radiactivo yodo-131 se utiliza para tratar enfermedades de la tiroides. Además, los isótopos se emplean en técnicas de imagen, como la tomografía por emisión de positrones (PET), donde se utilizan isótopos radiactivos para visualizar procesos biológicos en el cuerpo.
¿Por qué algunos elementos tienen un número de masa decimal?
Los elementos que tienen un número de masa decimal en la tabla periódica tienen múltiples isótopos con diferentes abundancias. El número de masa decimal es un promedio ponderado de las masas de los isótopos en función de su abundancia natural. Por ejemplo, el carbono tiene un número de masa de aproximadamente 12.01 debido a la presencia de isótopos de carbono-12 y carbono-13.
¿Cómo se determina la abundancia isotópica de un elemento?
La abundancia isotópica se determina mediante técnicas de espectrometría de masas, donde se analizan las proporciones de los diferentes isótopos de un elemento en una muestra. Esta técnica permite medir la masa y la abundancia de cada isótopo, proporcionando datos precisos sobre su distribución en la naturaleza.
¿El número de masa afecta las propiedades químicas de un elemento?
El número de masa en sí no afecta directamente las propiedades químicas de un elemento, ya que estas dependen principalmente de la configuración electrónica y el número atómico. Sin embargo, los isótopos pueden tener diferentes comportamientos en reacciones químicas, lo que puede influir en ciertas aplicaciones, como en la investigación científica y la industria.
¿Qué papel juega el número de masa en la formación de compuestos?
El número de masa es crucial en la formación de compuestos, ya que determina la proporción en la que los elementos se combinan. Por ejemplo, al calcular las fórmulas químicas, se considera el número de masa para asegurarse de que los reactivos se combinan en las proporciones correctas. Esto es especialmente importante en la química orgánica y en la síntesis de nuevos materiales.
¿Puedo calcular el número de masa de un elemento sin la tabla periódica?
Teóricamente, puedes calcular el número de masa de un elemento si conoces la cantidad de protones y neutrones. Sin embargo, la tabla periódica es una herramienta muy útil que proporciona información rápida y precisa sobre los elementos, incluyendo su número de masa promedio y abundancias isotópicas. Por lo tanto, es recomendable utilizarla siempre que sea posible.