Desde el comienzo de la humanidad, hemos estado fascinados por la naturaleza de la materia. ¿Qué es lo que compone todo lo que vemos a nuestro alrededor? La respuesta se encuentra en el concepto de átomo, la unidad básica de la materia. En este artículo, exploraremos a fondo el átomo, sus componentes esenciales como protones, electrones y neutrones, así como conceptos clave como el número atómico y la masa atómica. Comprender estos elementos no solo es fundamental para la química y la física, sino que también nos permite apreciar la complejidad y belleza del universo. Prepárate para adentrarte en el mundo microscópico donde cada pequeño átomo juega un papel crucial en la composición de todo lo que nos rodea.
¿Qué es un átomo?
El átomo es la unidad más pequeña de un elemento químico que conserva sus propiedades. Está formado por un núcleo central, que contiene protones y neutrones, y una nube de electrones que giran alrededor de este núcleo. Para visualizarlo, puedes imaginar un sistema solar en miniatura, donde el núcleo es el sol y los electrones son los planetas orbitando a su alrededor. La estructura del átomo fue desarrollada a lo largo de la historia, con contribuciones de científicos como Dalton, Thomson, Rutherford y Bohr, cada uno de los cuales aportó a nuestra comprensión actual.
La evolución del concepto de átomo
El concepto de átomo ha evolucionado significativamente desde la antigüedad. Los filósofos griegos, como Demócrito, fueron los primeros en sugerir que la materia estaba compuesta por partículas indivisibles. Sin embargo, fue en el siglo XIX cuando John Dalton formuló la teoría atómica moderna, que afirmaba que cada elemento estaba compuesto por átomos de un solo tipo. Posteriormente, J.J. Thomson descubrió el electrón, lo que llevó a la idea de que los átomos no son indivisibles, sino que están compuestos de partículas más pequeñas. La teoría del modelo atómico de Rutherford y el modelo de Bohr completaron la imagen que tenemos hoy en día.
Importancia del átomo en la ciencia
El estudio de los átomos es fundamental en varias ramas de la ciencia. En química, la comprensión de los átomos y sus interacciones permite explicar reacciones químicas, la formación de compuestos y la naturaleza de los materiales. En física, los átomos son esenciales para entender fenómenos como la energía nuclear y la estructura de la materia. Además, la biología molecular se basa en la interacción de átomos y moléculas para explicar procesos biológicos. Sin duda, el átomo es el ladrillo de construcción de toda la materia y su estudio es crucial para comprender el mundo que nos rodea.
Componentes del átomo: Protones, Electrones y Neutrones
Los átomos están compuestos por tres tipos principales de partículas subatómicas: protones, electrones y neutrones. Cada uno de estos componentes tiene propiedades únicas que influyen en el comportamiento del átomo y, por ende, en la materia misma.
Protones
Los protones son partículas con carga positiva que se encuentran en el núcleo del átomo. Cada elemento químico tiene un número específico de protones, lo que se conoce como número atómico. Por ejemplo, el hidrógeno tiene un protón, mientras que el oxígeno tiene ocho. Esta carga positiva de los protones es fundamental, ya que atrae a los electrones, que son partículas con carga negativa. La cantidad de protones en un átomo determina su identidad química y sus propiedades. Además, el número de protones en el núcleo también influye en la estabilidad del átomo, ya que un número elevado de protones puede resultar en una repulsión electrostática que se equilibra con la fuerza nuclear.
Electrones
Los electrones son partículas subatómicas que giran alrededor del núcleo del átomo en diferentes niveles de energía. Tienen una carga negativa y su número suele ser igual al de los protones en un átomo neutro, lo que hace que la carga total del átomo sea cero. Sin embargo, los electrones pueden ser ganados o perdidos, lo que resulta en la formación de iones. La disposición de los electrones en diferentes niveles de energía determina la reactividad química del átomo y su capacidad para formar enlaces con otros átomos. Los electrones más cercanos al núcleo tienen menos energía, mientras que aquellos en niveles más altos son más energéticos y, por lo tanto, más reactivos.
Neutrones
Los neutrones son partículas subatómicas que no tienen carga, lo que significa que son eléctricamente neutros. Se encuentran también en el núcleo del átomo y su número puede variar en átomos del mismo elemento, dando lugar a isótopos. Por ejemplo, el carbono tiene seis neutrones en su forma más común, pero también existe el carbono-14, que tiene ocho neutrones. Los neutrones son cruciales para la estabilidad del núcleo; actúan como un amortiguador que reduce la repulsión entre protones, permitiendo que los núcleos atómicos se mantengan unidos. Sin embargo, un número inadecuado de neutrones puede resultar en núcleos inestables que se descomponen radiactivamente.
Número Atómico y Masa Atómica
Dos conceptos clave que se derivan de la estructura atómica son el número atómico y la masa atómica. Ambos son esenciales para identificar y caracterizar a los elementos en la tabla periódica.
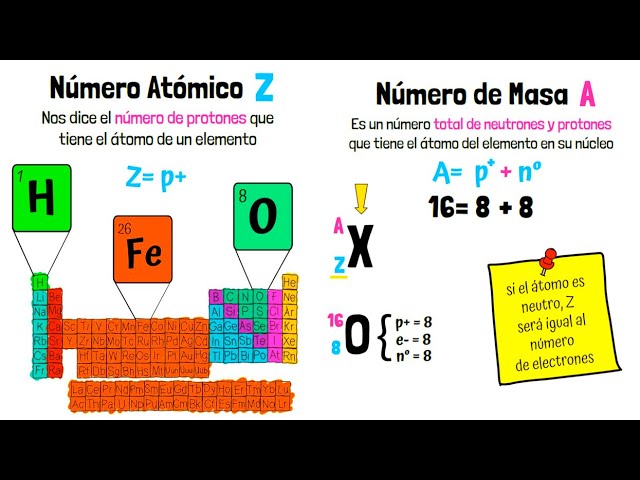
Número Atómico
El número atómico es el número de protones en el núcleo de un átomo y se representa con la letra «Z». Este número es único para cada elemento y determina su posición en la tabla periódica. Por ejemplo, el número atómico del hidrógeno es 1, mientras que el del oxígeno es 8. Además, el número atómico también indica la cantidad de electrones en un átomo neutro, lo que influye en la química del elemento. Los elementos se organizan en la tabla periódica en función de su número atómico, lo que permite predecir sus propiedades y comportamientos químicos.
Masa Atómica
La masa atómica, por otro lado, es la masa promedio de un átomo de un elemento, teniendo en cuenta la abundancia de sus isótopos. Se expresa en unidades de masa atómica (uma) y se calcula como la suma de los protones y neutrones en el núcleo. Por ejemplo, la masa atómica del carbono es aproximadamente 12 uma, lo que refleja su composición más común de seis protones y seis neutrones. Es importante notar que la masa atómica no es un número entero debido a la presencia de isótopos y a las diferencias en la masa de los neutrones y protones. La masa atómica también es fundamental para entender la estequiometría en reacciones químicas, ya que permite calcular la cantidad de reactivos y productos en una reacción.
Interacciones entre átomos
Los átomos no existen de forma aislada; interactúan constantemente entre sí, formando enlaces y compuestos que son la base de toda la química. Estas interacciones se pueden clasificar principalmente en tres tipos: enlaces covalentes, enlaces iónicos y enlaces metálicos.
Enlaces Covalentes
Los enlaces covalentes se forman cuando dos átomos comparten electrones. Este tipo de enlace es común entre átomos no metálicos que tienen energías de ionización similares. Por ejemplo, en una molécula de agua (H₂O), los átomos de hidrógeno comparten electrones con el átomo de oxígeno, creando un enlace covalente. Estos enlaces son fuertes y dan lugar a la formación de moléculas estables, lo que es esencial para la química orgánica y la biología.
Enlaces Iónicos
Los enlaces iónicos se producen cuando un átomo dona uno o más electrones a otro átomo, creando iones con cargas opuestas que se atraen entre sí. Un ejemplo clásico de un enlace iónico es el cloruro de sodio (sal de mesa), donde el sodio dona un electrón al cloro. Este tipo de enlace suele ocurrir entre metales y no metales, resultando en compuestos que suelen tener altos puntos de fusión y ebullición y que son solubles en agua.
Enlaces Metálicos
Los enlaces metálicos se caracterizan por una «nube» de electrones deslocalizados que se mueven libremente entre los átomos de un metal. Esto permite que los metales sean buenos conductores de electricidad y calor. Los enlaces metálicos son responsables de las propiedades únicas de los metales, como su maleabilidad y ductilidad. Un ejemplo de esto es el cobre, que es ampliamente utilizado en la electricidad debido a su alta conductividad.
Aplicaciones del conocimiento atómico
La comprensión del átomo y sus componentes tiene múltiples aplicaciones en diversas áreas, desde la medicina hasta la tecnología. Las aplicaciones más destacadas incluyen:
Medicina
En el campo de la medicina, el conocimiento atómico es fundamental para el desarrollo de técnicas de diagnóstico y tratamiento. La tomografía computarizada (TC) y la resonancia magnética (RM) utilizan principios atómicos para crear imágenes detalladas del interior del cuerpo. Además, la radioterapia utiliza isótopos radiactivos para tratar ciertos tipos de cáncer, destruyendo células malignas a nivel atómico.
Química y materiales
En química, el entendimiento de los átomos y sus interacciones es esencial para la síntesis de nuevos compuestos. Los científicos pueden diseñar moléculas específicas para crear nuevos medicamentos, plásticos o materiales avanzados. Por ejemplo, la nanotecnología se basa en manipular átomos y moléculas para desarrollar materiales con propiedades extraordinarias, como mayor resistencia o conductividad.
Energia Nuclear
La energía nuclear es otra área donde el conocimiento atómico tiene un impacto significativo. La fisión y la fusión nuclear son procesos que involucran cambios en el núcleo atómico, liberando enormes cantidades de energía. La fisión nuclear, utilizada en reactores nucleares, implica dividir núcleos pesados, mientras que la fusión nuclear, que ocurre en el sol, consiste en unir núcleos ligeros. Ambos procesos son objeto de investigación para proporcionar fuentes de energía más limpias y sostenibles.
¿Qué es un isótopo?
Un isótopo es una variante de un elemento que tiene el mismo número de protones, pero diferente número de neutrones. Esto significa que los isótopos de un mismo elemento tienen la misma carga y propiedades químicas, pero diferentes masas atómicas. Por ejemplo, el carbono tiene isótopos como el carbono-12 y el carbono-14, que son utilizados en datación radiométrica.
¿Cómo se determina la carga de un átomo?
La carga de un átomo se determina por la diferencia entre el número de protones y electrones. Si un átomo tiene el mismo número de protones (carga positiva) y electrones (carga negativa), es eléctricamente neutro. Si hay más protones que electrones, el átomo es positivo (catión); si hay más electrones que protones, es negativo (anión).
¿Qué es la energía de ionización?
La energía de ionización es la cantidad de energía necesaria para eliminar un electrón de un átomo en estado gaseoso. Este valor varía entre diferentes elementos y es un indicador de cuán fácilmente un átomo puede formar iones. Elementos con baja energía de ionización tienden a ser más reactivos, como los metales alcalinos.
¿Qué es un enlace químico?
Un enlace químico es la fuerza que mantiene unidos a dos átomos en una molécula. Existen diferentes tipos de enlaces, como covalentes, iónicos y metálicos, cada uno con características y propiedades únicas que determinan la estructura y reactividad de las sustancias químicas.
¿Qué papel juegan los electrones en la química?
Los electrones son fundamentales en la química porque son los responsables de las interacciones entre átomos. Su disposición en niveles de energía determina la reactividad química y la formación de enlaces. Los electrones en la capa más externa, conocidos como electrones de valencia, son los que participan en las reacciones químicas y en la formación de compuestos.
¿Cómo afecta el número de neutrones a un átomo?
El número de neutrones en un átomo afecta su masa atómica y su estabilidad. Diferentes números de neutrones dan lugar a isótopos, que pueden ser estables o inestables. Los isótopos inestables son radiactivos y pueden descomponerse, emitiendo radiación en el proceso. Esto tiene aplicaciones en medicina y energía nuclear.