El número atómico es uno de los conceptos más fundamentales en la química y la física. A menudo, se le considera como la «huella digital» de un elemento, ya que define sus propiedades y su comportamiento en reacciones químicas. Pero, ¿qué indica realmente el número atómico en un elemento químico? En este artículo, exploraremos la naturaleza del número atómico, su significado, cómo se relaciona con otros aspectos de la química y su relevancia en diversas aplicaciones. A medida que avancemos, entenderemos por qué esta cifra es esencial para la clasificación de los elementos en la tabla periódica y cómo influye en la vida cotidiana. Prepárate para descubrir la importancia del número atómico y su impacto en el mundo que nos rodea.
¿Qué es el Número Atómico?
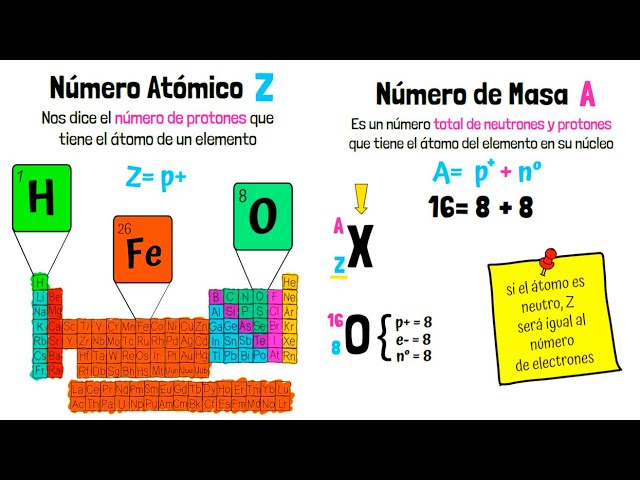
El número atómico, representado por la letra Z, es el número que identifica a un elemento químico en la tabla periódica. Se define como la cantidad de protones que tiene un átomo en su núcleo. Este número no solo determina la identidad del elemento, sino que también juega un papel crucial en su comportamiento químico y físico.
1 La Relación entre Proton y Número Atómico
Los protones son partículas subatómicas con carga positiva que se encuentran en el núcleo del átomo. Cada elemento en la tabla periódica tiene un número específico de protones. Por ejemplo, el hidrógeno, el elemento más simple, tiene un número atómico de 1, lo que significa que tiene un solo protón en su núcleo. Por otro lado, el oxígeno tiene un número atómico de 8, lo que indica que posee ocho protones. Esta relación directa entre el número de protones y el número atómico es fundamental para la clasificación de los elementos.
2 Comparación con el Número de Neutrones y Electrones
Es importante no confundir el número atómico con otros números que caracterizan a un átomo. Por ejemplo, el número de neutrones puede variar, dando lugar a diferentes isótopos del mismo elemento. Sin embargo, el número atómico permanece constante para cada elemento. Además, en un átomo neutro, el número de electrones, que son partículas con carga negativa, es igual al número atómico, equilibrando así la carga del átomo. Esta igualdad es crucial para entender la estabilidad y reactividad de los elementos.
La Tabla Periódica y el Número Atómico
La tabla periódica es una herramienta esencial en la química que organiza los elementos en función de su número atómico. Esta disposición no solo permite identificar rápidamente un elemento, sino que también proporciona información sobre sus propiedades y su comportamiento en reacciones químicas.
1 Organización de la Tabla Periódica
Los elementos se disponen en orden ascendente de acuerdo con su número atómico. Esto significa que el hidrógeno (Z=1) se encuentra en la parte superior izquierda, seguido por el helio (Z=2), y así sucesivamente. Esta organización ayuda a los químicos a prever cómo un elemento interactuará con otros, basándose en su posición en la tabla.
2 Grupos y Períodos
La tabla periódica está dividida en grupos y períodos. Los grupos son columnas verticales que contienen elementos con propiedades químicas similares, mientras que los períodos son filas horizontales que indican el número de capas de electrones en los átomos. La relación entre el número atómico y la posición en la tabla periódica permite a los científicos hacer predicciones sobre la reactividad y la formación de compuestos.
Propiedades Químicas y el Número Atómico
El número atómico influye en las propiedades químicas de un elemento, lo que a su vez afecta su comportamiento en reacciones. La estructura electrónica, que está determinada por el número atómico, juega un papel fundamental en la química de los elementos.
1 Estructura Electrónica
La estructura electrónica de un átomo se refiere a cómo se distribuyen los electrones en diferentes niveles de energía. Esta distribución está determinada por el número atómico. Por ejemplo, el carbono (Z=6) tiene seis electrones, que se distribuyen en dos niveles de energía: 2 en el primer nivel y 4 en el segundo. Esta configuración electrónica es clave para entender la capacidad del carbono para formar enlaces con otros átomos, lo que lo convierte en un elemento fundamental para la vida.
2 Reactividad Química
La reactividad de un elemento también está relacionada con su número atómico. Elementos en el mismo grupo, como los metales alcalinos, tienden a tener propiedades similares debido a que poseen configuraciones electrónicas parecidas. Por ejemplo, el sodio (Z=11) y el potasio (Z=19) son ambos altamente reactivos y tienden a perder un electrón para formar iones positivos. Esta similitud se puede atribuir a su número atómico y la estructura electrónica resultante.
Isótopos y el Número Atómico
Los isótopos son variantes de un mismo elemento que tienen el mismo número atómico pero diferente número de neutrones. Esto significa que, aunque tienen el mismo número de protones, su masa atómica es diferente, lo que puede influir en sus propiedades físicas y químicas.
1 Ejemplos de Isótopos
Tomemos el carbono como ejemplo. Existen varios isótopos de carbono, siendo los más comunes el carbono-12 y el carbono-14. Ambos tienen un número atómico de 6, pero el carbono-12 tiene seis neutrones, mientras que el carbono-14 tiene ocho. Esta diferencia en neutrones hace que el carbono-14 sea radiactivo, lo que se utiliza en datación arqueológica.
2 Importancia de los Isótopos en la Ciencia
Los isótopos tienen aplicaciones prácticas en diversas áreas. Por ejemplo, en medicina, los isótopos radiactivos se utilizan en tratamientos de cáncer y diagnósticos. En geología, los isótopos estables ayudan a entender procesos geológicos y climáticos. La capacidad de diferenciar entre isótopos se basa en el número atómico, lo que resalta su importancia en la ciencia.
Aplicaciones Prácticas del Número Atómico
El número atómico no es solo un concepto teórico; tiene múltiples aplicaciones prácticas en la vida diaria y en diversas industrias. Desde la medicina hasta la tecnología, su relevancia es innegable.
1 En la Medicina
En el ámbito médico, el número atómico juega un papel crucial en la radiología y la terapia con isótopos. Los isótopos radiactivos se utilizan para tratar enfermedades y realizar diagnósticos por imagen. Por ejemplo, el yodo-131, con un número atómico de 53, se usa para tratar trastornos de la tiroides. Su capacidad para concentrarse en la glándula tiroides y emitir radiación lo convierte en una herramienta valiosa en la medicina moderna.
2 En la Industria y Tecnología
En la industria, el número atómico es fundamental en la fabricación de materiales y productos. Los elementos se seleccionan en función de sus propiedades, que están determinadas por su número atómico. Por ejemplo, el uso de metales como el cobre (Z=29) y el aluminio (Z=13) en la construcción y la electrónica se basa en su conductividad y resistencia. La comprensión del número atómico permite a los ingenieros diseñar productos más eficientes y sostenibles.
El Futuro del Estudio del Número Atómico
A medida que avanzamos en la ciencia y la tecnología, el estudio del número atómico y sus implicaciones continúa evolucionando. Investigaciones en química, física y biología están ampliando nuestra comprensión de cómo se comportan los elementos y cómo podemos utilizar esa información para innovar en diversas áreas.
1 Nuevos Elementos y la Tabla Periódica
La búsqueda de nuevos elementos en la tabla periódica también está relacionada con el número atómico. Los científicos están constantemente explorando nuevas combinaciones y elementos sintéticos que podrían tener aplicaciones desconocidas hasta ahora. Cada nuevo elemento descubierto amplía nuestra comprensión de la materia y sus propiedades.
2 Impacto en la Educación y la Investigación
La enseñanza de la química y la física en las escuelas y universidades sigue siendo vital. Comprender el número atómico y su importancia es fundamental para formar a la próxima generación de científicos e ingenieros. La investigación continúa proporcionando nuevos datos y teorías que desafían nuestro entendimiento actual, lo que sugiere que el estudio del número atómico es un campo en constante expansión.
¿Qué es el número atómico y por qué es importante?
El número atómico es el número de protones en el núcleo de un átomo, que determina la identidad del elemento. Es importante porque define las propiedades químicas y físicas de un elemento, así como su posición en la tabla periódica.
¿Cómo se relaciona el número atómico con la masa atómica?
El número atómico se refiere al número de protones, mientras que la masa atómica es la suma de protones y neutrones en el núcleo. Por lo tanto, dos isótopos del mismo elemento tendrán el mismo número atómico pero diferente masa atómica debido a la variación en el número de neutrones.
¿Qué son los isótopos y cómo se relacionan con el número atómico?
Los isótopos son variantes de un elemento que tienen el mismo número atómico pero diferente número de neutrones. Esto significa que, aunque tienen el mismo número de protones, su masa atómica es diferente, lo que puede afectar sus propiedades y aplicaciones.
¿Cómo se utiliza el número atómico en la medicina?
En medicina, el número atómico es crucial para el uso de isótopos radiactivos en tratamientos y diagnósticos. Por ejemplo, el yodo-131, utilizado en el tratamiento de trastornos de la tiroides, tiene un número atómico de 53 y se concentra en la glándula tiroides para emitir radiación.
¿Por qué los elementos se organizan en la tabla periódica según el número atómico?
Los elementos se organizan en la tabla periódica según su número atómico para facilitar la identificación y comparación de sus propiedades. Esta disposición permite a los científicos prever el comportamiento químico de los elementos y sus interacciones en reacciones.
¿Qué aplicaciones tiene el número atómico en la industria?
En la industria, el número atómico se utiliza para seleccionar materiales con propiedades específicas, como conductividad y resistencia. Por ejemplo, el cobre y el aluminio son elegidos por su eficiencia en aplicaciones eléctricas y estructurales, basándose en su número atómico y propiedades relacionadas.
¿El número atómico cambia en los diferentes isótopos de un elemento?
No, el número atómico permanece constante para un elemento, independientemente de los isótopos. Lo que cambia entre los isótopos es el número de neutrones, lo que afecta la masa atómica, pero no la identidad del elemento.