Cuando pensamos en las reacciones químicas, muchas veces nos centramos en los productos y reactivos involucrados, pero un aspecto fundamental que a menudo pasa desapercibido es la energía que se libera o se absorbe durante estos procesos. La energía que se libera o se absorbe en reacciones químicas es un tema fascinante que no solo tiene implicaciones en la química, sino también en nuestra vida cotidiana, desde la cocina hasta la generación de energía. En este artículo, exploraremos en profundidad cómo se manifiestan estos cambios energéticos, qué tipos de reacciones existen, y cómo podemos medir y aplicar esta energía en diversas aplicaciones. Además, te ofreceremos ejemplos prácticos y responderemos a las preguntas más frecuentes sobre este tema. ¡Prepárate para sumergirte en el mundo de la química energética!
Fundamentos de la Energía en Reacciones Químicas
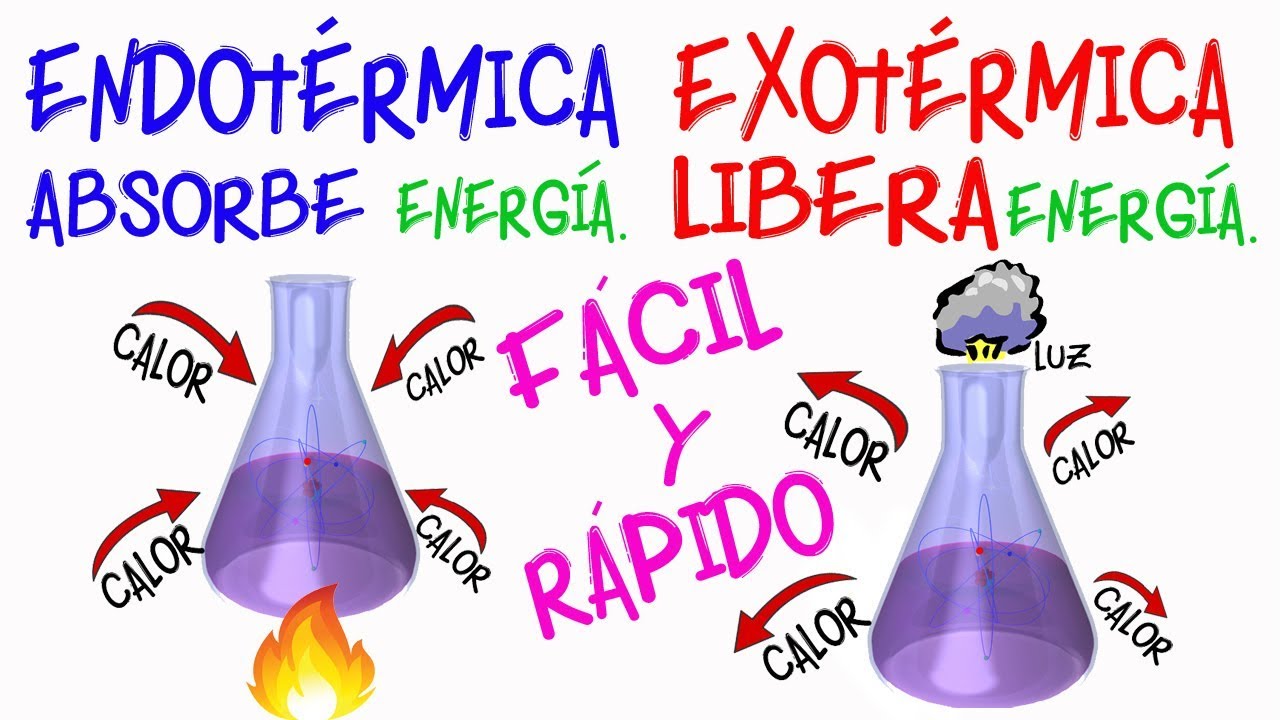
La energía es una propiedad esencial de la materia y se manifiesta de diversas formas. En el contexto de las reacciones químicas, es crucial entender cómo se comporta esta energía. Las reacciones químicas implican la ruptura y formación de enlaces entre átomos, y este proceso requiere o libera energía. En términos simples, hay dos tipos principales de reacciones según el intercambio energético: exergónicas y endergónicas.
1 Reacciones Exergónicas
Las reacciones exergónicas son aquellas que liberan energía al entorno. Este tipo de reacciones generalmente se asocian con la combustión de combustibles, donde la energía química almacenada en los enlaces se convierte en energía térmica y luminosa. Un ejemplo clásico es la combustión del metano (CH₄) en presencia de oxígeno (O₂), que produce dióxido de carbono (CO₂) y agua (H₂O), liberando una cantidad considerable de energía.
Un punto importante a considerar es que, aunque se libera energía, las reacciones exergónicas no siempre son espontáneas. Pueden requerir una energía de activación inicial, como una chispa para iniciar la combustión. Sin embargo, una vez que la reacción comienza, se produce un flujo continuo de energía hacia el exterior.
2 Reacciones Endergónicas
Por otro lado, las reacciones endergónicas son aquellas que requieren un aporte de energía para llevarse a cabo. Esto es común en procesos como la fotosíntesis, donde las plantas utilizan la energía solar para convertir dióxido de carbono y agua en glucosa y oxígeno. La energía absorbida en este caso es fundamental para la formación de enlaces en los productos finales.
En términos prácticos, las reacciones endergónicas suelen ocurrir en sistemas biológicos donde la energía se almacena y se utiliza posteriormente para realizar trabajo. Este tipo de reacciones son cruciales para la vida, ya que permiten el crecimiento y la reproducción de los organismos.
La Ley de Conservación de la Energía
La ley de conservación de la energía es un principio fundamental en la química y la física que establece que la energía no se crea ni se destruye, solo se transforma de una forma a otra. En el contexto de las reacciones químicas, esto significa que la cantidad total de energía en un sistema cerrado se mantiene constante, aunque puede cambiar de forma.
1 Implicaciones en Reacciones Químicas
Este principio tiene importantes implicaciones para entender cómo las reacciones químicas funcionan. Por ejemplo, en una reacción exergónica, la energía química almacenada en los enlaces de los reactivos se convierte en energía térmica, que se disipa en el entorno. En contraste, en una reacción endergónica, la energía externa se utiliza para romper enlaces en los reactivos, permitiendo que se formen nuevos enlaces en los productos.
Además, este principio se aplica en la medición de la energía involucrada en las reacciones. Los químicos utilizan herramientas como el calor de reacción, que se mide en calorías o joules, para cuantificar la energía liberada o absorbida durante un proceso químico. Esta medición es crucial en campos como la bioquímica, donde entender el flujo de energía es esencial para comprender los procesos metabólicos.
2 Ejemplos Prácticos de Conservación de Energía
Un ejemplo cotidiano de la conservación de energía se puede observar al cocinar. Cuando hervimos agua, la energía térmica de la estufa se transfiere al agua, aumentando su temperatura. Esta energía no desaparece; se transforma en energía cinética, que hace que las moléculas de agua se muevan más rápido, hasta que alcanzan el punto de ebullición. En este proceso, podemos observar cómo la energía se transforma, pero la cantidad total de energía en el sistema se mantiene constante.
Medición de la Energía en Reacciones Químicas
La medición de la energía en reacciones químicas es fundamental para entender su naturaleza y aplicabilidad. Existen diferentes métodos para medir la energía liberada o absorbida durante una reacción, siendo uno de los más comunes el uso de calorímetros.
1 Uso de Calorímetros
Los calorímetros son dispositivos diseñados para medir el cambio de temperatura de una sustancia durante una reacción química. Al medir este cambio de temperatura, se puede calcular la cantidad de energía involucrada en la reacción. Por ejemplo, si mezclamos un ácido y una base en un calorímetro, la reacción produce calor, lo que eleva la temperatura de la solución. Al registrar este cambio, podemos determinar cuánta energía se ha liberado.
Existen varios tipos de calorímetros, incluyendo calorímetros de bomba y calorímetros de café, cada uno con sus propias aplicaciones y niveles de precisión. Los calorímetros de bomba son más utilizados en estudios de combustión, mientras que los de café son ideales para reacciones que ocurren en solución.
2 Otras Técnicas de Medición
Además de los calorímetros, existen otras técnicas que los científicos utilizan para medir la energía en reacciones químicas. Por ejemplo, la espectroscopia puede ser utilizada para estudiar la energía de los enlaces en moléculas, mientras que la termodinámica proporciona un marco teórico para entender cómo se comporta la energía en diferentes condiciones. Estas técnicas son complementarias y ofrecen una visión más completa del comportamiento energético en reacciones químicas.
Aplicaciones de la Energía en Reacciones Químicas
La energía que se libera o se absorbe en reacciones químicas tiene múltiples aplicaciones en diversas industrias y en la vida diaria. Desde la producción de energía hasta la fabricación de productos químicos, estas reacciones son fundamentales para el funcionamiento de nuestra sociedad.
1 Generación de Energía
Uno de los ejemplos más evidentes de la aplicación de la energía en reacciones químicas es en la generación de energía. Las plantas de energía, por ejemplo, utilizan la combustión de combustibles fósiles para generar electricidad. En este proceso, la energía química almacenada en los combustibles se convierte en energía térmica, que se utiliza para calentar agua y generar vapor, que a su vez mueve turbinas para producir electricidad.
Sin embargo, no todas las fuentes de energía son fósiles. Las energías renovables, como la solar y la eólica, también dependen de principios químicos. Por ejemplo, las celdas solares convierten la energía solar en energía eléctrica a través de reacciones químicas en materiales semiconductores.
2 Productos Químicos y Materiales
La industria química también se beneficia enormemente de la energía en reacciones químicas. La síntesis de productos químicos, desde plásticos hasta medicamentos, implica reacciones donde se libera o se absorbe energía. Por ejemplo, la producción de amoníaco a partir de nitrógeno e hidrógeno en el proceso Haber-Bosch es una reacción endergónica que requiere condiciones específicas de temperatura y presión para llevarse a cabo eficientemente.
Además, los avances en la química de materiales han permitido desarrollar nuevos compuestos con propiedades únicas, lo que abre la puerta a innovaciones en tecnología, medicina y más. La comprensión de cómo se comporta la energía en estas reacciones es clave para optimizar procesos y reducir costos.
Reacciones Químicas en la Naturaleza
La naturaleza es un laboratorio vasto y complejo donde se llevan a cabo innumerables reacciones químicas. Estas reacciones no solo son fundamentales para la vida, sino que también son un excelente ejemplo de cómo la energía se libera o se absorbe en procesos biológicos.
1 Fotosíntesis: Capturando Energía del Sol
Un ejemplo icónico de una reacción endergónica en la naturaleza es la fotosíntesis. Las plantas utilizan la luz solar para convertir el dióxido de carbono y el agua en glucosa y oxígeno. Este proceso no solo proporciona energía a las plantas, sino que también es la base de la cadena alimentaria en la Tierra. La energía solar es absorbida y almacenada en enlaces químicos, que luego se utilizan para el crecimiento y desarrollo de la planta.
Este proceso no solo es fascinante desde el punto de vista químico, sino que también es vital para el ecosistema. La fotosíntesis es responsable de la producción de oxígeno, un elemento esencial para la vida en la Tierra.
2 Respiración Celular: Liberando Energía
Por otro lado, la respiración celular es un ejemplo de una reacción exergónica que ocurre en los organismos vivos. Durante este proceso, la glucosa producida en la fotosíntesis se descompone en presencia de oxígeno para liberar energía, que las células utilizan para llevar a cabo sus funciones vitales. Este proceso ilustra cómo la energía química almacenada en los alimentos se convierte en energía utilizable, manteniendo así la vida.
Impacto de la Energía en el Cambio Climático
El uso de la energía en reacciones químicas también tiene un impacto significativo en el cambio climático. La combustión de combustibles fósiles para la producción de energía es una de las principales fuentes de emisiones de gases de efecto invernadero, que contribuyen al calentamiento global.
1 Emisiones de Gases de Efecto Invernadero
Cuando quemamos combustibles fósiles, liberamos dióxido de carbono (CO₂) y otros gases a la atmósfera. Estos gases atrapan el calor, lo que contribuye al aumento de la temperatura global. La comprensión de la energía que se libera en estas reacciones es fundamental para desarrollar estrategias que mitiguen su impacto, como la transición a fuentes de energía renovable.
2 Soluciones Sostenibles
El desarrollo de tecnologías limpias y sostenibles, como la energía solar y eólica, busca aprovechar la energía de manera que minimice el impacto ambiental. Estas tecnologías dependen de reacciones químicas que son más eficientes y menos contaminantes. La investigación continua en este campo es vital para abordar los desafíos del cambio climático y promover un futuro más sostenible.
¿Qué es la energía de activación en una reacción química?
La energía de activación es la cantidad mínima de energía necesaria para iniciar una reacción química. Esta energía es esencial para romper los enlaces de los reactivos y permitir que se formen nuevos enlaces en los productos. Sin la energía de activación, las reacciones químicas no ocurrirían, incluso si son exergónicas.
¿Cómo se mide la energía liberada en una reacción?
La energía liberada en una reacción química se mide utilizando calorímetros, que registran el cambio de temperatura durante la reacción. A partir de este cambio de temperatura, los científicos pueden calcular la cantidad de energía que se ha liberado o absorbido. También se pueden utilizar otros métodos como la espectroscopia y técnicas termodinámicas.
¿Cuál es la diferencia entre una reacción endergónica y una exergónica?
La principal diferencia radica en el intercambio de energía. Las reacciones exergónicas liberan energía al entorno, mientras que las reacciones endergónicas requieren un aporte de energía para llevarse a cabo. Un ejemplo de reacción exergónica es la combustión, mientras que la fotosíntesis es un ejemplo de reacción endergónica.
¿Qué papel juega la energía en la vida diaria?
La energía liberada o absorbida en reacciones químicas tiene un papel fundamental en nuestra vida diaria. Desde la cocción de alimentos hasta la generación de electricidad, las reacciones químicas son esenciales para muchas de las actividades cotidianas. Además, la energía química en los alimentos es lo que nos permite realizar nuestras funciones vitales.
¿Cómo afectan las reacciones químicas al medio ambiente?
Las reacciones químicas, especialmente aquellas relacionadas con la combustión de combustibles fósiles, tienen un impacto significativo en el medio ambiente. La liberación de gases de efecto invernadero contribuye al cambio climático. Sin embargo, el desarrollo de tecnologías más limpias y sostenibles busca mitigar estos efectos y promover un futuro más ecológico.
¿Qué son las reacciones redox?
Las reacciones redox, o re