La entalpía de vaporización del etanol es un concepto fundamental en la química y la ingeniería que juega un papel crucial en diversas aplicaciones industriales y científicas. Este término se refiere a la cantidad de energía necesaria para transformar una cantidad dada de etanol de estado líquido a estado gaseoso a una temperatura y presión específicas. Con un uso creciente en biocombustibles, productos farmacéuticos y en la industria de bebidas, comprender las propiedades y el comportamiento del etanol en su proceso de vaporización es vital. En este artículo, exploraremos a fondo la entalpía de vaporización del etanol, sus propiedades, cómo se calculan estos valores y sus aplicaciones en diferentes campos. Prepárate para adentrarte en un tema fascinante que combina química, termodinámica y aplicaciones prácticas.
¿Qué es la entalpía de vaporización?
La entalpía de vaporización se define como la cantidad de energía necesaria para convertir una sustancia de estado líquido a vapor, manteniendo constante la temperatura y la presión. Esta propiedad es fundamental para entender procesos termodinámicos, especialmente en sistemas que involucran cambios de fase. La entalpía de vaporización se mide comúnmente en kilojulios por mol (kJ/mol).
1 Propiedades termodinámicas del etanol
El etanol, conocido comúnmente como alcohol etílico, es un líquido incoloro y volátil que se utiliza en diversas aplicaciones. Su fórmula química es C₂H₅OH, y su punto de ebullición a presión atmosférica es de aproximadamente 78.37 °C. La entalpía de vaporización del etanol es de alrededor de 38.56 kJ/mol a esta temperatura. Este valor indica que se requiere una cantidad significativa de energía para que el etanol pase de líquido a vapor, lo que tiene implicaciones en su uso en procesos industriales.
Además, el etanol presenta propiedades únicas que lo hacen adecuado para aplicaciones específicas. Por ejemplo, su baja viscosidad y su capacidad para mezclarse con agua lo convierten en un excelente disolvente en la industria química y farmacéutica. Asimismo, su entalpía de vaporización relativamente alta implica que se evapora lentamente, lo que es beneficioso en aplicaciones donde se requiere un control preciso de la liberación de vapor.
2 Factores que afectan la entalpía de vaporización
Varios factores pueden influir en la entalpía de vaporización del etanol. Entre ellos se incluyen:
- Temperatura: A medida que aumenta la temperatura, la energía cinética de las moléculas también aumenta, lo que puede reducir la cantidad de energía necesaria para la vaporización.
- Presión: A mayor presión, se requiere más energía para vaporizar el etanol, ya que las moléculas están más unidas entre sí.
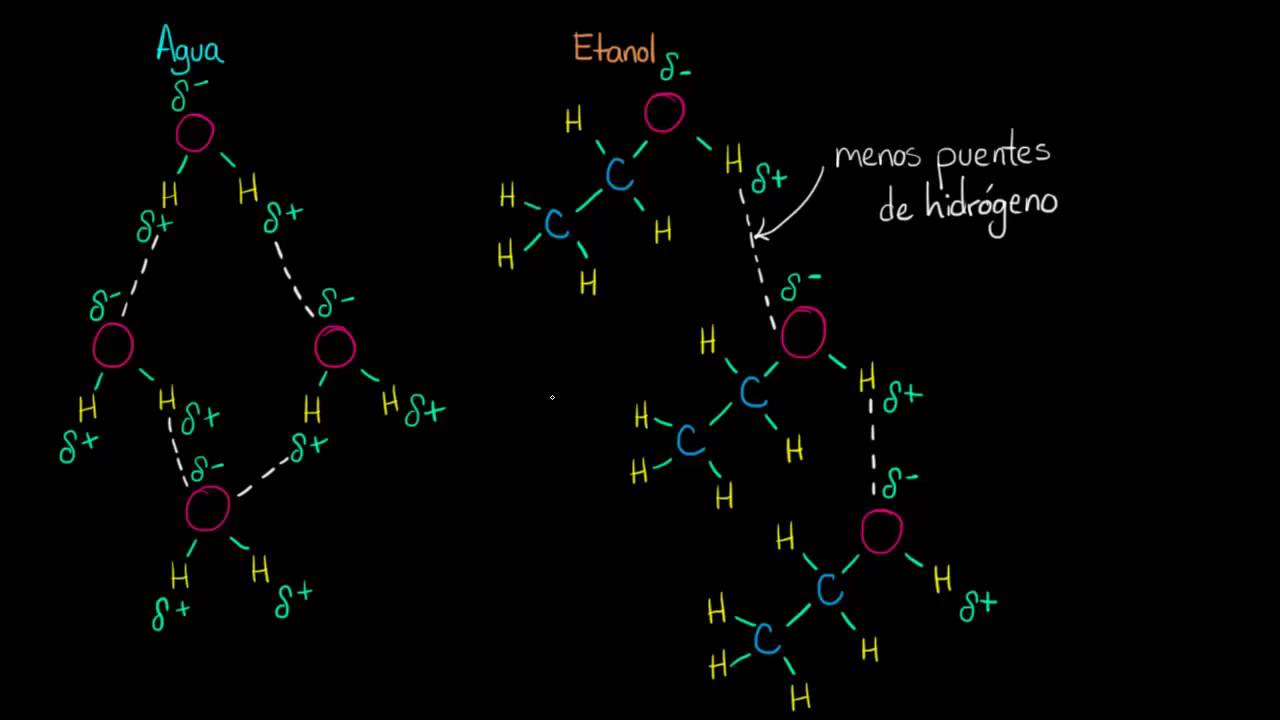
- Interacciones intermoleculares: Las fuerzas de atracción entre las moléculas de etanol (como los enlaces de hidrógeno) también afectan la entalpía de vaporización. Cuanto más fuertes sean estas interacciones, mayor será la energía requerida para la vaporización.
Cálculo de la entalpía de vaporización
Calcular la entalpía de vaporización del etanol puede hacerse utilizando diversas metodologías, incluyendo la aplicación de la ley de Clausius-Clapeyron, que relaciona la presión de vapor de un líquido con su temperatura y su entalpía de vaporización. La ecuación básica es:
ln(P2/P1) = -ΔHvap/R (1/T2 – 1/T1)
Donde:
- P1 y P2 son las presiones de vapor a las temperaturas T1 y T2, respectivamente.
- ΔHvap es la entalpía de vaporización.
- R es la constante de los gases (8.314 J/mol·K).
1 Ejemplo de cálculo
Imaginemos que queremos calcular la entalpía de vaporización del etanol a dos temperaturas diferentes. Supongamos que conocemos las presiones de vapor del etanol a 25 °C (P1) y a 78 °C (P2). Si P1 es 0.0042 atm y P2 es 0.59 atm, podemos usar la ecuación mencionada para encontrar ΔHvap. Al sustituir los valores y realizar los cálculos, obtendremos la entalpía de vaporización en kJ/mol.
Este tipo de cálculo es útil no solo para el etanol, sino para cualquier líquido en la investigación de sus propiedades termodinámicas. La comprensión de estos valores permite a los ingenieros y científicos diseñar procesos más eficientes en la industria.
2 Importancia de la entalpía de vaporización en procesos industriales
La entalpía de vaporización es un parámetro clave en procesos industriales como la destilación, la refrigeración y la absorción de calor. En la destilación, por ejemplo, se utiliza para separar componentes en mezclas líquidas basándose en sus diferentes puntos de ebullición. Al conocer la entalpía de vaporización del etanol, los ingenieros pueden diseñar columnas de destilación que optimicen la separación de etanol de otros compuestos.
En aplicaciones de refrigeración, la entalpía de vaporización también es crucial, ya que se utiliza para determinar la eficiencia de los refrigerantes y el rendimiento de los sistemas de enfriamiento. Así, el conocimiento de esta propiedad permite mejorar la sostenibilidad y eficiencia de procesos industriales.
Aplicaciones del etanol y su entalpía de vaporización
El etanol es un compuesto versátil con múltiples aplicaciones en diversas industrias. Su entalpía de vaporización juega un papel esencial en muchas de estas aplicaciones, ya que afecta su comportamiento en diferentes condiciones de operación.
1 Uso en biocombustibles
Una de las aplicaciones más relevantes del etanol en la actualidad es su uso como biocombustible. El etanol se produce a partir de la fermentación de azúcares y se mezcla comúnmente con gasolina para mejorar la eficiencia del combustible y reducir las emisiones de gases de efecto invernadero. La entalpía de vaporización del etanol es un factor clave en su desempeño como biocombustible, ya que influye en su capacidad para evaporarse y mezclarse con otros combustibles en el motor.
La combinación de etanol con gasolina puede mejorar la combustión, ya que el etanol tiene una mayor capacidad de absorción de calor y, por ende, una mayor entalpía de vaporización. Esto se traduce en una mayor eficiencia del motor y menores emisiones contaminantes. Además, el uso de etanol como biocombustible contribuye a la sostenibilidad, ya que se obtiene de fuentes renovables.
2 Aplicaciones farmacéuticas
El etanol también es ampliamente utilizado en la industria farmacéutica como disolvente y en la formulación de productos medicinales. Su entalpía de vaporización es un factor importante a considerar en la fabricación de medicamentos, ya que puede afectar la estabilidad y la liberación del principio activo. Por ejemplo, en la producción de jarabes y soluciones, la capacidad del etanol para evaporarse de manera controlada es crucial para lograr la concentración deseada de los ingredientes activos.
Además, el etanol se utiliza en la desinfección y limpieza de equipos médicos, gracias a sus propiedades antimicrobianas. La comprensión de su entalpía de vaporización permite a los fabricantes optimizar los procesos de limpieza y desinfección, garantizando la eficacia y seguridad de los productos farmacéuticos.
3 Uso en la industria de bebidas
En la industria de bebidas, el etanol es el componente principal de las bebidas alcohólicas. Su entalpía de vaporización influye en la forma en que se producen y almacenan estas bebidas. Por ejemplo, al embotellar vino o cerveza, es importante controlar la temperatura y la presión para evitar que el etanol se evapore demasiado rápido, lo que podría afectar el sabor y la calidad del producto final.
Asimismo, la entalpía de vaporización del etanol también es relevante en la producción de bebidas destiladas, donde se busca maximizar la concentración de etanol durante el proceso de destilación. Comprender esta propiedad permite a los productores ajustar los parámetros de operación y obtener un producto de alta calidad.
Comparación con otros líquidos
La entalpía de vaporización del etanol puede ser comparada con la de otros líquidos comunes para comprender mejor su comportamiento en diferentes aplicaciones. Por ejemplo, el agua tiene una entalpía de vaporización de aproximadamente 40.79 kJ/mol, lo que indica que se necesita más energía para vaporizar agua que para vaporizar etanol. Esto se debe a las fuertes interacciones de enlace de hidrógeno presentes en el agua, que son más intensas que las interacciones en el etanol.
1 Comparación con el metanol
El metanol, otro alcohol común, tiene una entalpía de vaporización de aproximadamente 35.3 kJ/mol. Aunque el metanol tiene una entalpía de vaporización más baja que el etanol, sus aplicaciones son diferentes. El metanol se utiliza principalmente como solvente y en la producción de formaldehído, mientras que el etanol tiene aplicaciones más amplias en biocombustibles y bebidas alcohólicas.
2 Comparación con otros solventes orgánicos
Al comparar la entalpía de vaporización del etanol con otros solventes orgánicos como el benceno (39.1 kJ/mol) y el acetona (31.0 kJ/mol), se puede observar que el etanol se encuentra en un rango intermedio. Esta propiedad hace que el etanol sea un solvente útil en aplicaciones donde se requiere un equilibrio entre la volatilidad y la capacidad de disolución.
¿Qué es la entalpía de vaporización y por qué es importante?
La entalpía de vaporización es la cantidad de energía necesaria para convertir un líquido en vapor. Es importante porque influye en procesos industriales como la destilación, la refrigeración y la fabricación de productos farmacéuticos. Conocer este valor permite optimizar estos procesos para mejorar la eficiencia y reducir costos.
¿Cómo se mide la entalpía de vaporización del etanol?
La entalpía de vaporización del etanol se puede medir experimentalmente utilizando calorímetros, que miden la cantidad de calor absorbido o liberado durante la vaporización. También se puede calcular utilizando la ley de Clausius-Clapeyron, que relaciona la presión de vapor y la temperatura con la entalpía de vaporización.
¿Qué aplicaciones tiene el etanol en la industria?
El etanol tiene diversas aplicaciones en la industria, incluyendo su uso como biocombustible, en la producción de bebidas alcohólicas, como disolvente en la industria química y farmacéutica, y en la desinfección de equipos médicos. Su versatilidad lo convierte en un compuesto valioso en múltiples sectores.
¿Por qué es relevante la entalpía de vaporización en la producción de biocombustibles?
La entalpía de vaporización es relevante en la producción de biocombustibles porque afecta la eficiencia de la combustión y la mezcla con otros combustibles. Un conocimiento adecuado de esta propiedad permite optimizar la producción y el rendimiento de los motores, contribuyendo a un uso más sostenible de los recursos.
¿Cómo afecta la temperatura a la entalpía de vaporización del etanol?
A medida que aumenta la temperatura, la energía cinética de las moléculas de etanol también aumenta, lo que puede reducir la cantidad de energía necesaria para vaporizarlo. Esto significa que la entalpía de vaporización disminuye a temperaturas más altas, lo que puede ser un factor importante en aplicaciones industriales donde se trabaja a diferentes temperaturas.
¿Cuál es la diferencia entre la entalpía de vaporización del etanol y la del agua?
La entalpía de vaporización del etanol es aproximadamente 38.56 kJ/mol, mientras que la del agua es de 40.79 kJ/mol. Esto significa que se necesita un poco menos de energía para vaporizar etanol que para vaporizar agua, lo que se debe a las diferentes fuerzas intermoleculares que actúan en cada sustancia.
¿Se puede utilizar etanol como refrigerante?
Sí, el etanol se puede utilizar como refrigerante en ciertos sistemas de refrigeración. Su entalpía de vaporización le permite absorber calor de manera eficiente, lo que lo convierte en una opción viable en aplicaciones específicas, aunque no es tan común como