La comprensión de la estructura atómica ha sido un viaje fascinante que ha evolucionado a lo largo de siglos. Desde las primeras teorías de la materia hasta los modelos complejos que conocemos hoy, cada avance histórico ha tenido un impacto significativo en cómo entendemos el mundo que nos rodea. Este artículo se adentra en los hitos más importantes en la historia del desarrollo de la estructura atómica, analizando cómo cada descubrimiento ha contribuido a nuestro conocimiento actual y ha transformado disciplinas como la química, la física y la biología. A lo largo de este análisis, exploraremos los principales científicos que han dejado su huella en este campo, los modelos atómicos que han sido propuestos y cómo estos han influido en la tecnología moderna y la investigación científica.
Los Primeros Conceptos de Materia
La historia de la estructura atómica comienza en la antigua Grecia, donde filósofos como Demócrito propusieron que la materia estaba compuesta por pequeñas partículas indivisibles llamadas «átomos». Aunque sus ideas eran más filosóficas que científicas, sentaron las bases para la investigación futura. La palabra «átomo» proviene del griego «atomos», que significa «indivisible». Sin embargo, no fue hasta el siglo XIX que se comenzaron a realizar experimentos que respaldaran estas teorías.
1 Demócrito y el Concepto de Átomo
Demócrito, junto con su maestro Leucipo, sugirió que todo lo que existe está compuesto por átomos en movimiento. Su visión era radical para su tiempo, ya que desafiaba las ideas predominantes sobre la materia. Sin embargo, su falta de evidencia empírica hizo que sus ideas fueran ignoradas durante siglos. Este concepto, aunque rudimentario, plantó la semilla que más tarde florecería en la teoría atómica moderna.
2 La Alquimia y la Búsqueda de la Materia Prima
Durante la Edad Media, la alquimia se convirtió en el precursor de la química moderna. Los alquimistas buscaban la piedra filosofal, un objeto legendario que supuestamente podía convertir metales comunes en oro y otorgar la inmortalidad. Aunque sus métodos eran a menudo místicos y no científicos, su trabajo contribuyó a la identificación de elementos y compuestos, sentando las bases para la química moderna. La alquimia nos enseñó que la materia podía transformarse, aunque no comprendieran los principios subyacentes.
El Siglo XIX: El Despertar Científico
El siglo XIX fue testigo de un resurgimiento en la investigación científica que llevó a la formulación de la teoría atómica moderna. La química comenzó a desarrollarse como una disciplina científica, y los experimentos proporcionaron evidencia tangible de la existencia de átomos y su comportamiento. La tabla periódica de elementos de Dmitri Mendeléyev y las leyes de conservación de la masa y la proporción definida de Joseph Proust fueron hitos cruciales que ayudaron a establecer un marco para la comprensión atómica.
1 La Ley de la Conservación de la Masa
La ley de la conservación de la masa, formulada por Antoine Lavoisier, sostiene que la masa total de los reactivos en una reacción química es igual a la masa total de los productos. Este principio fue fundamental para demostrar que las reacciones químicas implican la reorganización de átomos, y no la creación o destrucción de materia. Esta comprensión permitió a los científicos empezar a visualizar la estructura atómica como un sistema dinámico en lugar de una simple colección de partículas.
2 La Tabla Periódica y la Clasificación de Elementos
La creación de la tabla periódica por Mendeléyev fue un avance monumental. Organizó los elementos conocidos según sus propiedades químicas y físicas, lo que permitió predecir la existencia y las propiedades de elementos aún no descubiertos. Esta clasificación no solo confirmó la existencia de átomos, sino que también proporcionó un marco para entender cómo interactúan entre sí. La tabla periódica se convirtió en una herramienta fundamental para los químicos, guiando investigaciones futuras y ayudando a identificar patrones en la naturaleza.
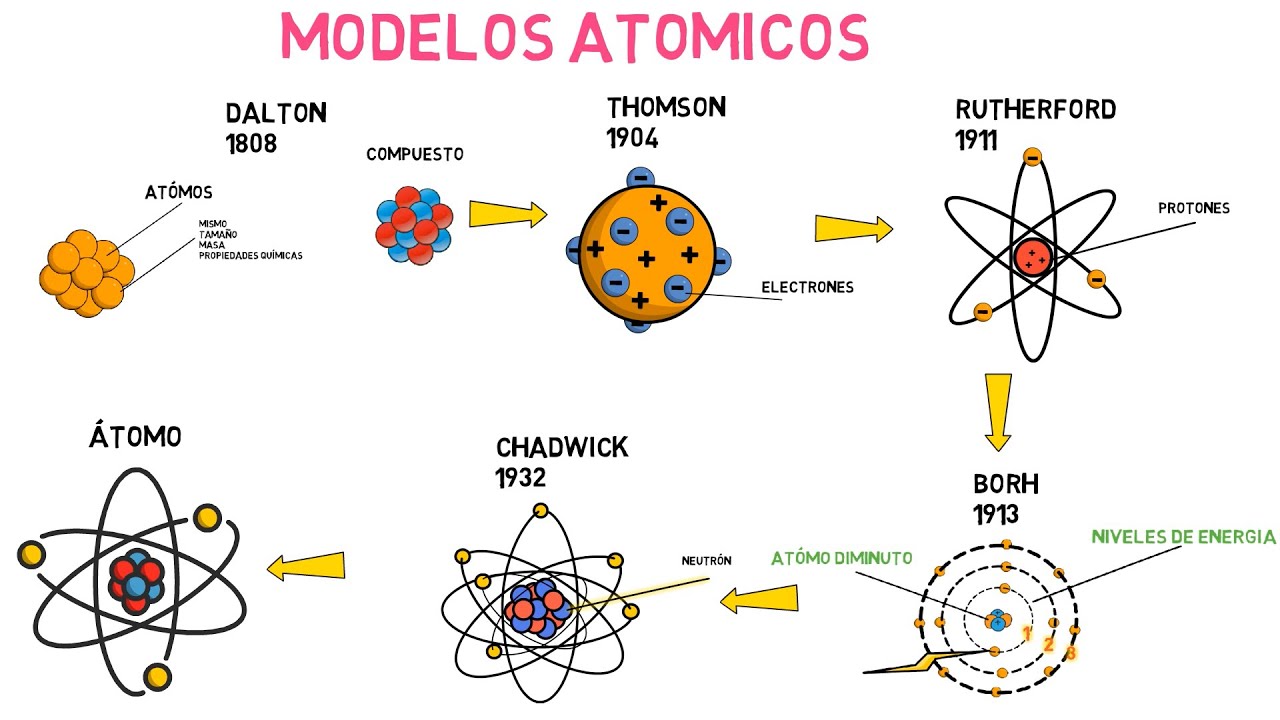
El Modelo Atómico de Dalton
John Dalton, en el siglo XIX, propuso el primer modelo atómico científico basado en experimentos y observaciones. Su teoría atómica afirmaba que cada elemento está compuesto por átomos indivisibles y que los compuestos se forman cuando los átomos de diferentes elementos se combinan en proporciones fijas. Este modelo fue fundamental para la química, ya que proporcionó una base científica para la comprensión de la materia.
1 Postulados de Dalton
Los postulados de Dalton son esenciales para comprender la evolución de la teoría atómica. Según Dalton:
- Todos los elementos están compuestos por átomos indivisibles.
- Los átomos de un mismo elemento son idénticos en masa y propiedades.
- Los compuestos se forman mediante la combinación de átomos de diferentes elementos en proporciones fijas.
- Las reacciones químicas implican la reorganización de átomos, sin que estos se creen o destruyan.
Estos postulados no solo respaldaron la idea de que la materia está compuesta por átomos, sino que también sentaron las bases para la química moderna.
2 Limitaciones del Modelo de Dalton
A pesar de su importancia, el modelo de Dalton tenía limitaciones. No podía explicar fenómenos como la existencia de isótopos, que son átomos del mismo elemento con diferentes masas. Además, no abordaba la estructura interna del átomo. Estas limitaciones llevaron a la necesidad de nuevos modelos que pudieran explicar mejor la naturaleza de la materia.
Avances en la Comprensión de la Estructura Atómica
A medida que la investigación avanzaba, se hicieron descubrimientos que desafiaron y ampliaron la comprensión de la estructura atómica. Los experimentos de Thomson, Rutherford y Bohr llevaron a la formulación de modelos más complejos que incluían electrones y núcleos atómicos. Cada uno de estos científicos aportó una pieza clave al rompecabezas atómico.
1 El Modelo de Thomson: El Pudding de Pasas
J.J. Thomson, en 1897, descubrió el electrón, lo que llevó a la modificación del modelo atómico. Propuso el modelo del «pudding de pasas», donde los electrones estaban incrustados en una esfera positiva de carga. Aunque este modelo fue un gran avance, no pudo explicar la estructura nuclear del átomo.
2 El Experimento de Rutherford: Descubrimiento del Núcleo
Ernest Rutherford, a través de su famoso experimento de dispersión de partículas alfa en 1911, demostró que el átomo tiene un núcleo denso y cargado positivamente. Este descubrimiento revolucionó la comprensión de la estructura atómica y llevó a la creación del modelo nuclear, donde los electrones orbitan alrededor del núcleo. La idea de un núcleo atómico cambió la forma en que los científicos pensaban sobre la materia y abrió nuevas vías de investigación.
3 El Modelo de Bohr: Niveles de Energía
Niels Bohr, en 1913, propuso un modelo que introdujo la idea de niveles de energía cuantizados. Según su modelo, los electrones orbitan el núcleo en niveles específicos y solo pueden saltar entre estos niveles al absorber o emitir energía. Este modelo explicó la estabilidad de los átomos y la emisión de luz en diferentes longitudes de onda, lo que fue crucial para el desarrollo de la espectroscopía.
La Mecánica Cuántica y el Modelo Atómico Moderno
La llegada de la mecánica cuántica en el siglo XX transformó radicalmente la comprensión de la estructura atómica. La teoría cuántica introdujo conceptos como la dualidad onda-partícula y la probabilidad, desafiando la visión clásica de los átomos. Este nuevo marco permitió a los científicos desarrollar un modelo atómico más preciso y complejo.
1 Principios de la Mecánica Cuántica
La mecánica cuántica establece que, en lugar de trayectorias definidas, los electrones existen en nubes de probabilidad. Esto significa que no podemos determinar con precisión la ubicación de un electrón en un momento dado, sino que podemos calcular la probabilidad de encontrarlo en una región específica del espacio. Este concepto ha llevado a la creación de modelos atómicos más avanzados, como el modelo cuántico del átomo.
2 El Modelo Cuántico del Átomo
El modelo cuántico describe a los electrones como partículas en forma de nubes alrededor del núcleo, con diferentes niveles de energía y orbitales. Esta representación permite una comprensión más profunda de la química y la reactividad de los elementos. Los orbitales atómicos, que describen la probabilidad de encontrar un electrón en un área determinada, son fundamentales para entender cómo los átomos se combinan y forman moléculas.
Impacto en la Tecnología Moderna y la Investigación Científica
La evolución de la teoría atómica ha tenido un impacto profundo en múltiples disciplinas. Desde el desarrollo de nuevas tecnologías hasta avances en la medicina, la comprensión de la estructura atómica ha sido fundamental para innovaciones que han cambiado el mundo. La física nuclear, la química de materiales y la biología molecular son solo algunas de las áreas que se han beneficiado de estos avances.
1 Aplicaciones en la Medicina
La comprensión de la estructura atómica ha llevado a importantes aplicaciones en medicina, como la radioterapia y la tomografía por emisión de positrones (PET). Estos métodos utilizan principios de física nuclear para diagnosticar y tratar enfermedades, como el cáncer. La investigación en medicina nuclear sigue siendo un campo en expansión, con nuevas técnicas que emergen continuamente.
2 Innovaciones en Materiales
La química de materiales se ha visto revolucionada por la teoría atómica. Desde la creación de nuevos compuestos hasta la ingeniería de materiales a nanoescala, el entendimiento de la estructura atómica permite diseñar materiales con propiedades específicas. Esto ha llevado a avances en la electrónica, la energía renovable y la nanotecnología, con aplicaciones que impactan la vida diaria.
¿Qué es la estructura atómica?
La estructura atómica se refiere a la organización interna de un átomo, que incluye el núcleo, compuesto por protones y neutrones, y los electrones que orbitan alrededor de este núcleo. Esta estructura es fundamental para entender las propiedades químicas y físicas de los elementos.
¿Quién fue el primer científico en proponer un modelo atómico?
Demócrito fue uno de los primeros filósofos en proponer la idea de que la materia está compuesta por átomos indivisibles. Sin embargo, el primer modelo atómico científico fue formulado por John Dalton en el siglo XIX, basado en experimentos y observaciones.
¿Qué avances trajo la mecánica cuántica a la teoría atómica?
La mecánica cuántica introdujo conceptos como la dualidad onda-partícula y la probabilidad en la descripción de los electrones. Esto permitió desarrollar un modelo atómico más preciso, donde los electrones son descritos por nubes de probabilidad en lugar de trayectorias definidas, lo que ha revolucionado la química y la física.
¿Cómo ha influido la teoría atómica en la medicina?
La teoría atómica ha permitido el desarrollo de tecnologías médicas avanzadas, como la radioterapia y la tomografía por emisión de positrones (PET), que utilizan principios de física nuclear para diagnosticar y tratar enfermedades, mejorando así los resultados de salud y la calidad de vida de los pacientes.
¿Cuál es la importancia de la tabla periódica en la química?
La tabla periódica organiza los elementos según sus propiedades y características, lo que permite a los científicos predecir el comportamiento químico y las interacciones entre ellos. Es una herramienta esencial en la química, facilitando la comprensión de la materia y sus reacciones.
¿Qué impacto tiene el modelo atómico en la tecnología moderna?
El modelo atómico ha permitido el desarrollo de nuevas tecnologías en diversas áreas, como la electrónica, la energía renovable y la nanotecnología. Estos avances han transformado nuestra vida cotidiana y continúan impulsando la innovación en múltiples disciplinas.