La masa atómica es un concepto fundamental en la química y la física, pero a menudo causa confusión. Si alguna vez te has preguntado por qué la masa atómica de un elemento no es un número entero, no estás solo. Este fenómeno se debe a la existencia de isótopos, que son variantes de un elemento con diferentes números de neutrones, y a la manera en que se calcula la masa atómica promedio de un elemento en la tabla periódica. En este artículo, exploraremos a fondo las razones detrás de esta curiosidad científica, ofreciendo ejemplos claros que te ayudarán a comprender mejor este tema fascinante. Desde la composición de los átomos hasta cómo se determina la masa atómica, abordaremos todas las facetas de la pregunta: ¿por qué la masa atómica no es un número entero?
¿Qué es la masa atómica?
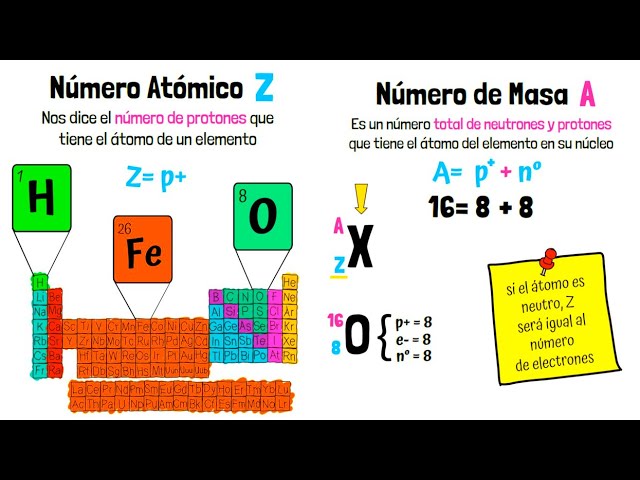
La masa atómica es una medida que indica la cantidad de materia en un átomo de un elemento. Se expresa en unidades de masa atómica (uma), donde un uma se define como una doceava parte de la masa de un átomo de carbono-12. Este valor es esencial para entender la química, ya que permite calcular la cantidad de sustancia en reacciones químicas y en compuestos. La masa atómica de un elemento se puede encontrar en la tabla periódica, y aunque muchos elementos tienen masas atómicas que parecen ser números enteros, la mayoría no lo son.
1 La composición de un átomo
Un átomo está compuesto por protones, neutrones y electrones. Los protones y neutrones se encuentran en el núcleo, mientras que los electrones orbitan alrededor de este. La masa atómica se calcula principalmente a partir de la suma de la masa de los protones y neutrones, ya que la masa de los electrones es mucho menor y no tiene un impacto significativo en la masa total del átomo. Sin embargo, cada isótopo de un elemento tiene un número diferente de neutrones, lo que provoca que la masa atómica promedio no sea un número entero.
2 Unidades de masa atómica
La unidad de masa atómica es una medida que se utiliza para expresar la masa de los átomos de forma más conveniente. Por ejemplo, la masa atómica del hidrógeno es aproximadamente 1.008 uma, que no es un número entero. Esto se debe a que la masa atómica promedio se calcula considerando la abundancia natural de sus isótopos. Así, aunque el hidrógeno tiene un isótopo más común, el protio (con un protón y sin neutrones), también tiene deuterio y tritio, que contribuyen a su masa promedio.
La existencia de isótopos
Los isótopos son átomos de un mismo elemento que tienen el mismo número de protones pero diferente número de neutrones. Esto significa que, aunque comparten propiedades químicas similares, sus masas atómicas varían. Por ejemplo, el carbono tiene tres isótopos principales: carbono-12, carbono-13 y carbono-14. El carbono-12 tiene 6 protones y 6 neutrones, el carbono-13 tiene 6 protones y 7 neutrones, y el carbono-14 tiene 6 protones y 8 neutrones. La masa atómica promedio del carbono, que es 12.01 uma, refleja la abundancia de estos isótopos en la naturaleza.
1 Abundancia de isótopos
La masa atómica promedio se calcula considerando la abundancia relativa de cada isótopo. Por ejemplo, el carbono-12 es el isótopo más abundante, representando aproximadamente el 98.89% del carbono encontrado en la naturaleza. Por otro lado, el carbono-13 es mucho menos común, representando aproximadamente el 1.11%. Al calcular la masa atómica promedio, se toma en cuenta esta distribución, resultando en un número que no es un entero.
2 Ejemplos de isótopos en otros elementos
Los isótopos no son exclusivos del carbono. Por ejemplo, el oxígeno tiene tres isótopos principales: oxígeno-16, oxígeno-17 y oxígeno-18. La masa atómica promedio del oxígeno es de 16.00 uma, pero esta cifra también es el resultado de la abundancia de cada isótopo. En el caso del oxígeno, el oxígeno-16 es el más abundante, lo que influye en su masa atómica promedio. Este patrón se repite en muchos otros elementos, donde la existencia de isótopos es clave para entender por qué sus masas atómicas no son números enteros.
Cálculo de la masa atómica promedio
El cálculo de la masa atómica promedio es un proceso que involucra la suma ponderada de las masas de todos los isótopos de un elemento, teniendo en cuenta su abundancia relativa. Este cálculo se puede expresar mediante la siguiente fórmula:
masa atómica promedio = (masa del isótopo 1 × abundancia del isótopo 1) + (masa del isótopo 2 × abundancia del isótopo 2) + …
1 Un ejemplo práctico: el cloro
Tomemos como ejemplo el cloro, que tiene dos isótopos principales: cloro-35 y cloro-37. La masa del cloro-35 es aproximadamente 34.97 uma y la del cloro-37 es aproximadamente 36.97 uma. La abundancia del cloro-35 en la naturaleza es alrededor del 75.76%, mientras que el cloro-37 representa aproximadamente el 24.24%. Al aplicar la fórmula mencionada, obtenemos:
- masa atómica promedio = (34.97 uma × 0.7576) + (36.97 uma × 0.2424) = 35.45 uma
Este resultado, 35.45 uma, es un número no entero, que refleja la influencia de ambos isótopos en la masa atómica promedio del cloro.
2 Implicaciones del cálculo en la química
Entender cómo se calcula la masa atómica promedio es fundamental para los químicos, ya que esta información se utiliza en diversas aplicaciones. Por ejemplo, al realizar cálculos estequiométricos en reacciones químicas, los químicos deben conocer la masa atómica de los reactivos y productos para determinar las proporciones correctas. Así, una comprensión clara de por qué la masa atómica no es un número entero permite una mejor planificación y ejecución de experimentos químicos.
La relación entre la masa atómica y la estabilidad nuclear
La estabilidad de un núcleo atómico está influenciada por la relación entre protones y neutrones. En general, los núcleos con un número equilibrado de protones y neutrones tienden a ser más estables. Sin embargo, cuando hay demasiados o muy pocos neutrones en relación con los protones, la estabilidad puede verse comprometida, llevando a la radiactividad. Esta variación en la estabilidad nuclear también es un factor que contribuye a la existencia de isótopos y, por ende, a que la masa atómica promedio de un elemento no sea un número entero.
1 Efecto de la radiactividad en la masa atómica
La radiactividad se produce cuando un núcleo atómico inestable se descompone en un proceso que libera energía y partículas. Este fenómeno está relacionado con los isótopos, ya que algunos isótopos son radiactivos y otros no. Por ejemplo, el carbono-14 es un isótopo radiactivo que se utiliza en datación por radiocarbono. Su presencia en pequeñas cantidades en el carbono natural contribuye a la masa atómica promedio del carbono, que, como hemos visto, no es un número entero.
2 La estabilidad y su relación con la tabla periódica
La estabilidad de los isótopos de un elemento también puede influir en su posición en la tabla periódica. Elementos con isótopos estables tienden a ser más comunes y, por lo tanto, más representativos en la tabla. Por otro lado, los elementos con isótopos inestables pueden ser menos comunes y, en algunos casos, no se encuentran en la naturaleza en grandes cantidades. Esta relación entre estabilidad y masa atómica también es un aspecto clave para entender por qué la masa atómica no es un número entero.
La importancia de la masa atómica en la ciencia
La masa atómica es un concepto que va más allá de la química y la física; tiene implicaciones en diversas áreas de la ciencia, incluyendo la biología, la medicina y la ingeniería. Conocer la masa atómica de un elemento permite a los científicos realizar cálculos precisos, desarrollar nuevos materiales y comprender mejor los procesos biológicos.
1 Aplicaciones en biología y medicina
En biología, la masa atómica es crucial para entender procesos como la fotosíntesis y la respiración celular. Por ejemplo, en la fotosíntesis, las plantas utilizan el carbono, y conocer su masa atómica permite calcular la cantidad de dióxido de carbono que absorben. En medicina, la comprensión de la masa atómica de elementos como el oxígeno y el carbono es esencial para el desarrollo de medicamentos y tratamientos.
2 Innovaciones en ingeniería y tecnología
En ingeniería, la masa atómica también juega un papel importante. Al diseñar nuevos materiales, los ingenieros deben considerar la masa atómica de los elementos involucrados para asegurar que el material cumpla con las especificaciones necesarias. Por ejemplo, en la fabricación de aleaciones metálicas, la combinación de diferentes elementos y sus masas atómicas determina las propiedades finales del material, como su resistencia y durabilidad.
Ahora que hemos explorado en profundidad el tema de la masa atómica y por qué no es un número entero, es útil resumir los conceptos clave:
- La masa atómica es la medida de la cantidad de materia en un átomo, calculada principalmente a partir de protones y neutrones.
- Los isótopos son variantes de un elemento con diferente número de neutrones, lo que influye en la masa atómica promedio.
- La masa atómica promedio se calcula considerando la abundancia relativa de cada isótopo.
- La estabilidad nuclear y la radiactividad son factores que afectan la masa atómica y su representación en la tabla periódica.
- La masa atómica tiene aplicaciones en diversas áreas de la ciencia, desde la biología hasta la ingeniería.
¿Por qué algunos elementos tienen masas atómicas enteras?
Algunos elementos, como el carbono-12, tienen una masa atómica que es un número entero porque su composición isotópica es tal que su masa promedio coincide exactamente con la masa de uno de sus isótopos. Sin embargo, la mayoría de los elementos tienen isótopos que contribuyen a una masa atómica promedio que no es un número entero.
¿Cómo afecta la masa atómica a las reacciones químicas?
La masa atómica es fundamental para calcular las proporciones en las reacciones químicas. Los químicos utilizan la masa atómica para determinar cuántos gramos de un reactivo son necesarios para reaccionar con otros reactivos, lo que es esencial para la estequiometría y el equilibrio químico.
¿Qué es la unidad de masa atómica (uma)?
La unidad de masa atómica (uma) es una medida que se utiliza para expresar la masa de los átomos. Se define como una doceava parte de la masa de un átomo de carbono-12. Esta unidad es útil para trabajar con las masas atómicas en un formato más manejable.
¿Todos los isótopos son radiactivos?
No, no todos los isótopos son radiactivos. Muchos isótopos son estables y no sufren descomposición, mientras que otros son inestables y se descomponen a través de la radiactividad. Por ejemplo, el carbono-12 y el carbono-13 son estables, mientras que el carbono-14 es radiactivo.
¿Cómo se determina la abundancia de los isótopos en la naturaleza?
La abundancia de los isótopos se determina a través de técnicas analíticas avanzadas, como la espectrometría de masas. Estas técnicas permiten medir la cantidad de cada isótopo presente en una muestra y, por lo tanto, calcular su abundancia relativa, que es fundamental para determinar la masa atómica promedio de un elemento.
¿Por qué es importante entender la masa atómica en biología?
Entender la masa atómica es crucial en biología porque afecta a procesos biológicos fundamentales, como la fotos