Las bases son una de las categorías más importantes en la química, junto a los ácidos. Su comprensión es fundamental no solo en el ámbito académico, sino también en nuestra vida diaria. Desde el jabón que utilizamos para lavar hasta los productos de limpieza que encontramos en casa, las bases están presentes en muchas de las sustancias que nos rodean. Este artículo tiene como objetivo sumergirte en el fascinante mundo de las bases en química. A lo largo de las siguientes secciones, exploraremos qué son las bases, sus propiedades, cómo se comportan en diferentes reacciones químicas, su clasificación y su importancia en la industria y la biología. ¡Prepárate para descubrir todo lo que necesitas saber sobre las bases!
¿Qué son las Bases?
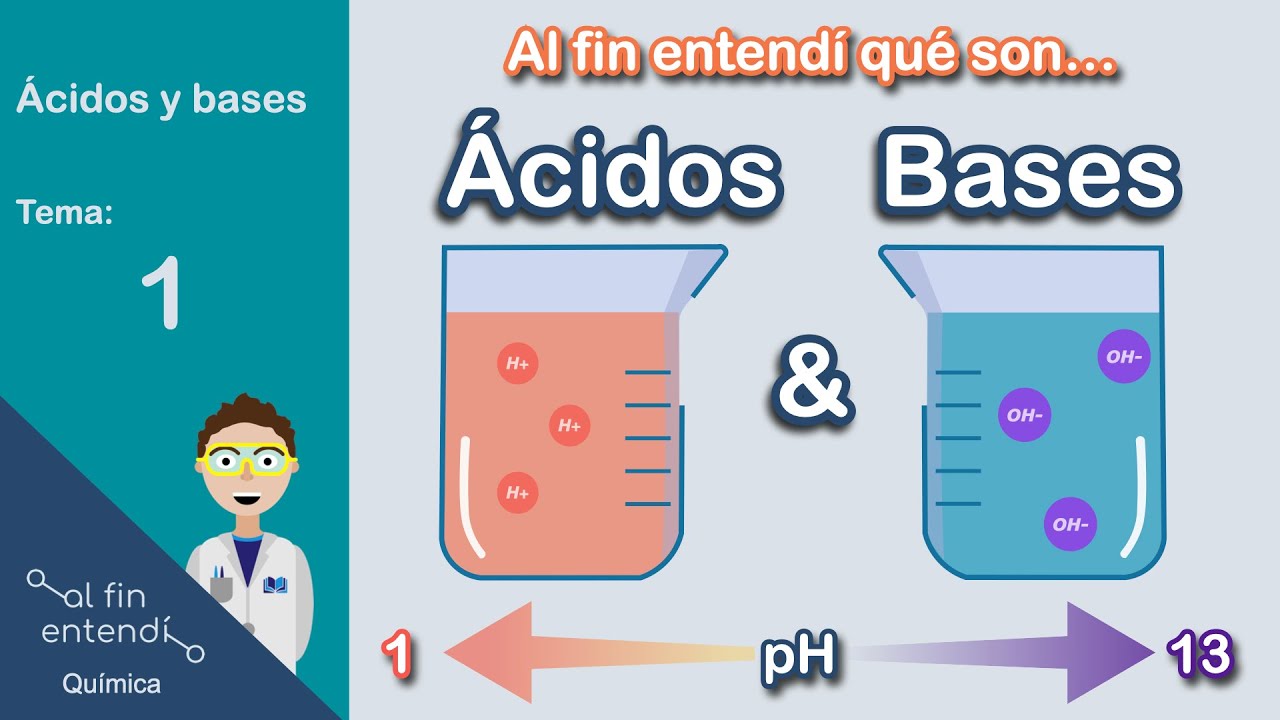
Las bases son compuestos químicos que, en solución acuosa, tienen la capacidad de aceptar protones (H+) o donar pares de electrones. En términos más sencillos, las bases son sustancias que pueden neutralizar los ácidos. Pero, ¿cómo podemos identificar una base? Generalmente, presentan un sabor amargo y son resbaladizas al tacto, como el jabón. También tienen un pH mayor a 7, lo que las distingue de los ácidos, que tienen un pH menor a 7.
Definición y Conceptos Clave
La definición de base ha evolucionado con el tiempo. Originalmente, se definían como sustancias que contenían hidróxido (OH–), pero hoy en día, se utilizan varias teorías para describir su comportamiento:
- Teoría de Arrhenius: Según esta teoría, una base es una sustancia que, al disolverse en agua, produce iones hidróxido.
- Teoría de Brønsted-Lowry: Define a las bases como sustancias que aceptan protones. Esta teoría amplía la comprensión de las bases a reacciones no acuosas.
- Teoría de Lewis: En esta definición, una base es cualquier sustancia que puede donar un par de electrones a otra sustancia, lo que incluye muchas más sustancias que no se clasifican como bases según las teorías anteriores.
Esta diversidad de definiciones muestra que las bases son mucho más que simples compuestos químicos; son fundamentales para entender una amplia gama de reacciones químicas en la naturaleza.
Propiedades Físicas y Químicas de las Bases
Las propiedades de las bases son diversas y pueden clasificarse en físicas y químicas. Conocer estas propiedades es esencial para entender cómo interactúan con otras sustancias.
Propiedades Físicas
Las propiedades físicas de las bases incluyen:
- Estado físico: Muchas bases son sólidos a temperatura ambiente, como el hidróxido de sodio (NaOH), aunque algunas, como el amoníaco (NH3), son gases.
- Sabor y textura: Las bases suelen tener un sabor amargo y una textura resbaladiza, lo que puede ser evidente al tocarlas.
- Color: Algunas bases pueden cambiar de color en presencia de indicadores de pH, como el papel tornasol, que se torna azul en soluciones básicas.
Propiedades Químicas
En cuanto a las propiedades químicas, las bases tienen características distintivas que las hacen reaccionar de maneras específicas:
- Neutralización: Las bases reaccionan con ácidos para formar agua y sal, un proceso conocido como neutralización. Por ejemplo, el ácido clorhídrico (HCl) reacciona con el hidróxido de sodio (NaOH) para formar cloruro de sodio (sal de mesa) y agua.
- Reacciones de precipitación: Algunas bases pueden reaccionar con ciertos metales para formar precipitados insolubles. Por ejemplo, el hidróxido de cobre (II) se forma cuando se mezcla una base con una solución de cobre.
- Reacciones de saponificación: Las bases son fundamentales en la fabricación de jabones, un proceso que implica la reacción de grasas con una base fuerte.
Estas propiedades hacen que las bases sean extremadamente útiles en diversas aplicaciones, desde la industria hasta la biología.
Clasificación de las Bases
Las bases se pueden clasificar de varias maneras, según su fuerza, su solubilidad y su composición química. Esta clasificación es útil para entender su comportamiento en diferentes contextos.
Clasificación según su Fuerza
Las bases se dividen en fuertes y débiles:
- Bases Fuertes: Son aquellas que se disocian completamente en solución acuosa. Ejemplos incluyen el hidróxido de sodio (NaOH) y el hidróxido de potasio (KOH).
- bases Débiles: Estas no se disocian completamente, lo que significa que en equilibrio hay una mezcla de la forma disociada y no disociada. Un ejemplo es el hidróxido de amonio (NH4OH).
Clasificación según su Solubilidad
Las bases también pueden ser solubles o insolubles en agua:
- Bases Solubles: Estas se disuelven en agua, como el NaOH, lo que les permite tener un efecto inmediato en las reacciones químicas.
- bases Insolubles: Estas no se disuelven en agua, como el hidróxido de bario (Ba(OH)2), que puede reaccionar con ácidos en condiciones específicas.
Importancia de las Bases en la Industria
Las bases tienen un papel crucial en numerosas industrias, desde la fabricación de productos de limpieza hasta la producción de alimentos. Aquí te mostramos algunas de sus aplicaciones más relevantes:
Producción de Productos Químicos
Las bases son fundamentales en la producción de una amplia gama de productos químicos. Por ejemplo, el hidróxido de sodio se utiliza en la fabricación de papel, detergentes y productos petroquímicos. Su capacidad para neutralizar ácidos los convierte en agentes esenciales en muchos procesos de producción.
Industria Alimentaria
En la industria alimentaria, las bases son utilizadas para ajustar el pH de los productos. Por ejemplo, el bicarbonato de sodio (NaHCO3) se utiliza como agente leudante en la panadería. Además, algunas bases se emplean en la conservación de alimentos, ayudando a prevenir el crecimiento de microorganismos.
Producción de Jabones y Detergentes
La saponificación, el proceso de fabricación de jabones, requiere bases fuertes como el NaOH o KOH. Estas bases reaccionan con grasas o aceites para producir glicerol y jabones, que son emulsionantes y limpiadores eficaces.
Las Bases en la Biología
Las bases no solo son importantes en la química y la industria, sino que también juegan un papel esencial en la biología. Su influencia se puede ver en varios procesos biológicos clave:
pH y Funciones Biológicas
El pH de un entorno biológico es crucial para el funcionamiento de las células. Muchas reacciones bioquímicas dependen de un pH específico, y las bases ayudan a regular este pH. Por ejemplo, el bicarbonato de sodio actúa como un amortiguador en la sangre, manteniendo un pH equilibrado que es vital para la salud.
Metabolismo y Digestión
Las bases también son esenciales en procesos metabólicos. En el estómago, el ácido clorhídrico (HCl) se secreta para ayudar en la digestión, pero en el intestino delgado, las bases como el bicarbonato de sodio neutralizan este ácido para proteger las paredes intestinales y permitir que las enzimas digestivas funcionen adecuadamente.
¿Cuál es la diferencia entre un ácido y una base?
La principal diferencia entre ácidos y bases radica en su comportamiento químico. Los ácidos son sustancias que donan protones (H+) en solución, mientras que las bases aceptan protones o donan electrones. Esto se traduce en diferentes propiedades, como el sabor, la textura y el pH. Por ejemplo, los ácidos tienen un sabor agrio y un pH menor a 7, mientras que las bases son amargas y tienen un pH mayor a 7.
¿Por qué son importantes las bases en la limpieza?
Las bases son fundamentales en la limpieza debido a su capacidad para descomponer grasas y aceites. Muchos productos de limpieza contienen bases como el hidróxido de sodio o el bicarbonato de sodio, que ayudan a eliminar manchas y residuos. Su pH alto también permite neutralizar ácidos, lo que es útil para limpiar superficies que han sido afectadas por sustancias ácidas.
¿Las bases pueden ser peligrosas?
Sí, algunas bases pueden ser peligrosas si no se manejan adecuadamente. Las bases fuertes, como el hidróxido de sodio, pueden causar quemaduras químicas en la piel y daños en los ojos. Es importante utilizar equipo de protección personal y seguir las instrucciones de seguridad al trabajar con estas sustancias.
¿Qué son los indicadores de pH y cómo funcionan?
Los indicadores de pH son sustancias que cambian de color según el pH de la solución en la que se encuentran. Por ejemplo, el tornasol se vuelve rojo en soluciones ácidas y azul en soluciones básicas. Estos indicadores son útiles para determinar si una solución es ácida o básica, lo que es crucial en laboratorios y en aplicaciones industriales.
¿Se pueden encontrar bases en la naturaleza?
Sí, muchas bases se encuentran en la naturaleza. Por ejemplo, el bicarbonato de sodio se encuentra en forma de minerales y se utiliza en procesos biológicos. Además, las bases como el amoníaco se producen de manera natural a partir de la descomposición de materia orgánica. Su presencia es esencial para mantener el equilibrio químico en los ecosistemas.
¿Cómo afectan las bases a nuestro cuerpo?
Las bases son cruciales para el funcionamiento de nuestro cuerpo. Mantienen el pH adecuado en la sangre y otros fluidos corporales, lo que es esencial para las reacciones enzimáticas. Sin embargo, un exceso de bases puede causar alcalosis, una condición que puede alterar el funcionamiento normal del organismo. Por eso, el equilibrio es clave.
¿Qué papel juegan las bases en la agricultura?
En agricultura, las bases son importantes para ajustar el pH del suelo. Su aplicación puede ayudar a neutralizar suelos ácidos, lo que mejora la disponibilidad de nutrientes para las plantas. Además, algunas bases se utilizan en fertilizantes para promover el crecimiento de cultivos saludables.