La química es una ciencia fascinante que no solo estudia la materia, sino también cómo interactúa en diversas condiciones. Uno de los conceptos clave en química es el logaritmo, una herramienta matemática que, aunque puede parecer abstracta, tiene aplicaciones prácticas muy concretas. En particular, el logaritmo se utiliza para entender el pH, un parámetro crucial en la química que mide la acidez o basicidad de una solución. En este artículo, exploraremos en profundidad qué es un logaritmo, cómo se relaciona con el pH y por qué es fundamental en la química. Además, analizaremos ejemplos prácticos y responderemos preguntas frecuentes para que tengas una comprensión completa del tema.
¿Qué es un Logaritmo?
Para comprender la relación entre los logaritmos y el pH, primero debemos desglosar qué es un logaritmo. En términos simples, un logaritmo es la operación matemática que responde a la pregunta: «¿A qué potencia debo elevar un número base para obtener otro número?» La forma más común de logaritmos es el logaritmo en base 10, denotado como log10 o simplemente log.
Definición Formal de Logaritmo
Matemáticamente, si tenemos una ecuación de la forma:
by = x
y = logb(x)
Por ejemplo, si consideramos 102 = 100, podemos expresar esto como log10(100) = 2. Esta propiedad es fundamental en la matemática y se utiliza en diversas disciplinas, incluida la química.
Propiedades de los Logaritmos
Los logaritmos tienen varias propiedades que los hacen útiles en cálculos complejos:
- Producto: logb(xy) = logb(x) + logb(y)
- Cociente: logb(x/y) = logb(x) – logb(y)
- Potencia: logb(xn) = n * logb(x)
Estas propiedades son esenciales para simplificar cálculos en química, donde se manejan concentraciones y reacciones químicas que requieren un análisis detallado.
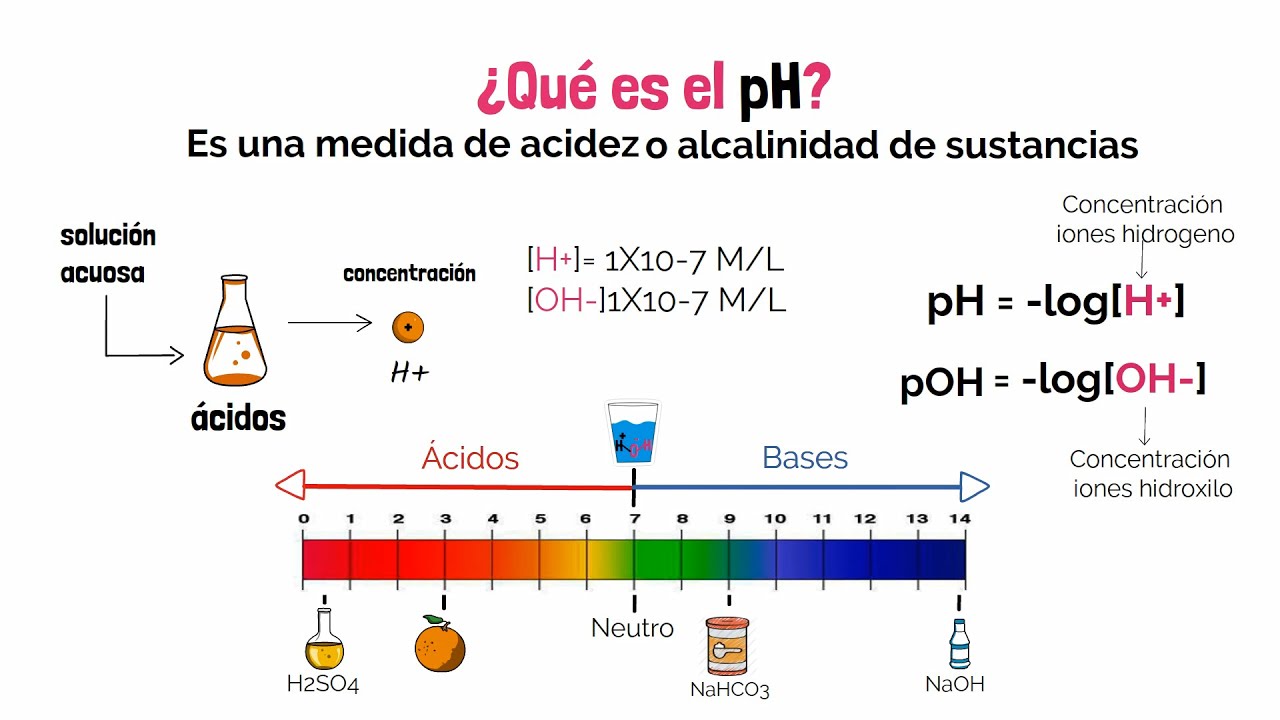
El pH: ¿Qué es y Cómo se Mide?
El pH es una medida que indica la acidez o basicidad de una solución. Se define como el logaritmo negativo de la concentración de iones hidrógeno ([H+]) en una solución. La fórmula es:
pH = -log10[H+]
Esto significa que a medida que la concentración de iones hidrógeno aumenta, el pH disminuye, indicando una solución más ácida. Por el contrario, una menor concentración de iones hidrógeno resulta en un pH más alto, indicando una solución más básica.
Escala de pH
La escala de pH va de 0 a 14:
- pH 0-6: Ácido
- pH 7: Neutro
- pH 8-14: Básico
Un pH de 7 es considerado neutro, lo que significa que hay una concentración equilibrada de iones hidrógeno y hidróxido. Por ejemplo, el agua pura tiene un pH de 7, mientras que el ácido clorhídrico (HCl) tiene un pH mucho más bajo, alrededor de 1, indicando una alta acidez.
Importancia del pH en Química
El pH es un factor crítico en numerosas reacciones químicas y procesos biológicos. Por ejemplo, en la agricultura, el pH del suelo afecta la disponibilidad de nutrientes para las plantas. En el ámbito médico, el pH de la sangre debe mantenerse dentro de un rango específico para asegurar el correcto funcionamiento del organismo. Además, en la industria, el pH es fundamental en la producción de productos químicos y en el tratamiento de aguas residuales.
La Relación entre Logaritmos y pH
La conexión entre logaritmos y pH es fundamental para entender cómo se mide la acidez. Como hemos mencionado, el pH se calcula usando el logaritmo negativo de la concentración de iones hidrógeno. Esto significa que pequeñas variaciones en la concentración de [H+] pueden resultar en cambios significativos en el pH. Por ejemplo, una solución con una concentración de 0.01 M de H+ tiene un pH de 2, mientras que una concentración de 0.001 M tiene un pH de 3. Este cambio de una unidad en pH representa un cambio de diez veces en la concentración de iones hidrógeno.
Ejemplos Prácticos de la Relación Logaritmo-pH
Para ilustrar mejor esta relación, consideremos algunos ejemplos:
- Una solución con una concentración de 0.1 M de HCl tiene un pH de 1, lo que indica una alta acidez.
- Una solución con una concentración de 0.0001 M de HCl tiene un pH de 4, mostrando que es menos ácida.
Esto nos ayuda a entender cómo se aplican los logaritmos en situaciones prácticas y cómo los químicos pueden manipular las condiciones para obtener los resultados deseados en sus experimentos.
Aplicaciones del pH en Diversas Áreas de la Ciencia
El pH tiene un impacto considerable en diversas disciplinas científicas, desde la biología hasta la ingeniería química. Vamos a explorar algunas de las aplicaciones más relevantes.
En Biología
En biología, el pH es crucial para procesos metabólicos. Por ejemplo, las enzimas, que son catalizadores biológicos, funcionan mejor en rangos específicos de pH. Si el pH se desvía demasiado de este rango óptimo, la actividad enzimática puede disminuir, afectando así las reacciones bioquímicas. Un ejemplo clásico es la pepsina, una enzima digestiva que funciona mejor en ambientes ácidos, como el estómago, donde el pH es bajo.
En Medicina
En medicina, el pH de la sangre es un indicador crítico de la salud del paciente. El rango normal de pH en la sangre humana es de 7.35 a 7.45. Cualquier desviación de este rango puede ser indicativa de problemas de salud, como acidosis o alcalosis. Por eso, los médicos realizan pruebas de pH en sangre para evaluar la condición del paciente y tomar decisiones sobre el tratamiento adecuado.
En la Industria
En la industria, el pH es fundamental en la producción de productos químicos, alimentos y bebidas. Por ejemplo, el pH influye en la fermentación de la cerveza y el vino, donde un pH adecuado es necesario para que las levaduras funcionen correctamente. Asimismo, en el tratamiento de aguas residuales, el control del pH es esencial para asegurar que los procesos de purificación sean efectivos y que el agua tratada sea segura para el medio ambiente.
¿Qué es un logaritmo en términos simples?
Un logaritmo es una operación matemática que responde a la pregunta de qué potencia se debe elevar un número base para obtener otro número. Por ejemplo, en el logaritmo en base 10, log10(100) = 2, porque 10 elevado a la potencia de 2 es igual a 100.
¿Cómo se relaciona el pH con la acidez de una solución?
El pH mide la concentración de iones hidrógeno en una solución. Un pH bajo (menos de 7) indica alta acidez, mientras que un pH alto (más de 7) indica basicidad. Un pH de 7 es considerado neutro.
¿Por qué es importante el pH en la agricultura?
El pH del suelo afecta la disponibilidad de nutrientes para las plantas. Un pH adecuado asegura que los nutrientes estén en formas que las plantas pueden absorber. Un suelo demasiado ácido o básico puede limitar el crecimiento de las plantas.
¿Qué sucede si el pH de la sangre se desvía de su rango normal?
Si el pH de la sangre se desvía de 7.35 a 7.45, puede indicar problemas de salud. La acidosis (pH bajo) o la alcalosis (pH alto) pueden afectar el funcionamiento de los órganos y sistemas del cuerpo, lo que puede ser potencialmente peligroso.
¿Cómo se mide el pH en un laboratorio?
El pH se mide comúnmente usando un medidor de pH, un dispositivo que puede proporcionar lecturas precisas de la acidez o basicidad de una solución. También se pueden usar tiras reactivas que cambian de color según el pH de la solución.
¿Qué papel juegan los logaritmos en la química?
Los logaritmos son esenciales en química para simplificar cálculos relacionados con concentraciones, como en el caso del pH. Ayudan a manejar números muy grandes o muy pequeños, haciendo que las ecuaciones sean más manejables y comprensibles.
¿Existen otros usos de los logaritmos en la ciencia?
Sí, los logaritmos se utilizan en muchas áreas de la ciencia, incluyendo la física y la biología. Por ejemplo, se utilizan en la ley de decaimiento radiactivo, en la escala Richter para medir terremotos, y en la biología para describir el crecimiento poblacional.