El número atómico es uno de los conceptos más fundamentales en el estudio de la química, actuando como un pilar en la clasificación de los elementos. Pero, ¿qué significa realmente este número y por qué es tan crucial para entender la materia que nos rodea? En este artículo, exploraremos a fondo qué indica el número atómico de un elemento, su relación con la estructura atómica y su impacto en la química y la vida cotidiana. Desde cómo se determina el número atómico hasta su papel en la tabla periódica, te invitamos a descubrir la importancia de este concepto en el fascinante mundo de la química.
Definición del Número Atómico
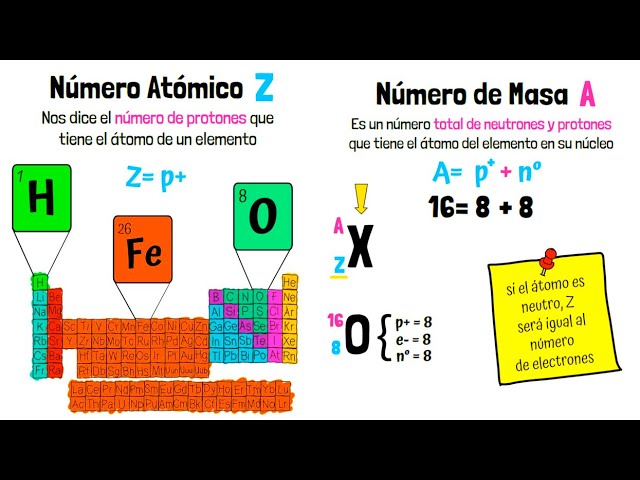
El número atómico, representado por la letra «Z», es el número que identifica a un elemento químico en la tabla periódica. Este número atómico corresponde a la cantidad de protones presentes en el núcleo de un átomo de ese elemento. Por ejemplo, el hidrógeno, que tiene un número atómico de 1, posee un solo protón en su núcleo, mientras que el carbono, con un número atómico de 6, tiene seis protones.
1 Relación entre Número Atómico y Protonación
La protonación es un concepto clave en la química que se refiere a la cantidad de protones en el núcleo de un átomo. Dado que el número atómico es igual al número de protones, podemos deducir que cada elemento en la tabla periódica tiene una identidad única basada en su número atómico. Esta identidad es fundamental para entender las propiedades químicas de los elementos, ya que la cantidad de protones también determina el número de electrones en un átomo neutro.
2 Número Atómico y Neutrones
Es importante señalar que el número atómico no nos dice nada sobre la cantidad de neutrones en el núcleo. Los isótopos de un elemento tienen el mismo número atómico pero diferentes números de neutrones. Por ejemplo, el carbono-12 y el carbono-14 son isótopos del carbono, ambos con un número atómico de 6, pero con 6 y 8 neutrones, respectivamente. Esta variación en la cantidad de neutrones influye en la estabilidad del núcleo y en las propiedades nucleares del elemento.
La Tabla Periódica y el Número Atómico
La tabla periódica es una representación organizada de los elementos químicos, y el número atómico es el criterio fundamental para su ordenación. Los elementos están dispuestos en orden ascendente según su número atómico, lo que permite una comprensión más clara de sus propiedades y comportamientos químicos. Esta organización es crucial para los químicos, ya que facilita la predicción de reacciones y comportamientos.
1 Organización de la Tabla Periódica
La disposición de los elementos en la tabla periódica no solo se basa en el número atómico, sino que también refleja la configuración electrónica de los átomos. Por ejemplo, los elementos en la misma columna (o grupo) comparten propiedades químicas similares debido a la similar configuración de electrones en su capa externa. Esto significa que el número atómico no solo define al elemento, sino que también proporciona información sobre cómo se comportará en reacciones químicas.
2 Grupos y Períodos
Los elementos se agrupan en columnas llamadas grupos y en filas llamadas períodos. Los elementos de un mismo grupo, como los metales alcalinos, tienen un número atómico creciente, pero comparten características químicas similares. Por otro lado, los períodos indican un cambio en la configuración electrónica, lo que también afecta las propiedades del elemento. Así, el número atómico es fundamental no solo para la identificación de los elementos, sino también para entender sus interacciones.
Importancia del Número Atómico en la Química
El número atómico no es solo una cifra; tiene implicaciones profundas en la química y en la ciencia en general. Desde la formación de compuestos hasta la predicción de reacciones, el número atómico es una herramienta esencial para los químicos.
1 Predicción de Comportamientos Químicos
Conocer el número atómico de un elemento permite a los químicos predecir cómo interactuará con otros elementos. Por ejemplo, el sodio (número atómico 11) reacciona de manera diferente con el cloro (número atómico 17) en comparación con el magnesio (número atómico 12). Esta capacidad de anticipar comportamientos es crucial en la síntesis de nuevos compuestos y en el desarrollo de materiales.
2 Aplicaciones en la Industria y la Tecnología
El número atómico también tiene aplicaciones prácticas en diversas industrias. En la farmacéutica, por ejemplo, el conocimiento de los números atómicos ayuda en la creación de medicamentos que interactúan de manera específica con ciertas moléculas en el cuerpo. Asimismo, en la tecnología de materiales, el número atómico guía el diseño de nuevos compuestos con propiedades deseadas, como la conductividad o la resistencia.
Ejemplos Prácticos del Número Atómico
Para ilustrar la importancia del número atómico, veamos algunos ejemplos concretos que destacan su relevancia en la química.
1 Agua y su Composición Molecular
El agua (H₂O) es un ejemplo clásico que muestra cómo el número atómico influye en la química. El hidrógeno tiene un número atómico de 1, mientras que el oxígeno tiene un número atómico de 8. Esta diferencia en los números atómicos explica las propiedades únicas del agua, como su capacidad para disolver muchas sustancias y su alto calor específico.
2 Carbono y su Rol en la Vida
El carbono, con un número atómico de 6, es fundamental para la química orgánica y la vida tal como la conocemos. Su capacidad para formar enlaces covalentes con otros elementos, incluyendo otros átomos de carbono, permite la creación de una diversidad de compuestos orgánicos. Esto es esencial en la biología, ya que las moléculas como proteínas, carbohidratos y ácidos nucleicos están compuestas principalmente de carbono.
Al reflexionar sobre el número atómico, es evidente que este concepto no solo define a un elemento, sino que también proporciona una base para comprender el comportamiento químico y las interacciones entre diferentes elementos. Su importancia en la química, la biología y la industria es innegable, haciendo del número atómico un tema fundamental en el estudio de la ciencia.
¿Qué es el número atómico y cómo se representa?
El número atómico es la cantidad de protones en el núcleo de un átomo y se representa con la letra «Z». Este número determina la identidad del elemento en la tabla periódica y su comportamiento químico.
¿Cómo afecta el número atómico a las propiedades de un elemento?
El número atómico afecta las propiedades de un elemento al determinar la cantidad de electrones en un átomo neutro, lo que influye en su reactividad y en cómo se une con otros elementos.
¿Por qué los isótopos tienen el mismo número atómico?
Los isótopos de un elemento tienen el mismo número atómico porque tienen la misma cantidad de protones, pero difieren en el número de neutrones. Esto les da diferentes masas atómicas y propiedades nucleares.
¿Qué papel juega el número atómico en la tabla periódica?
En la tabla periódica, los elementos están organizados en orden ascendente de su número atómico, lo que permite clasificar los elementos de acuerdo a sus propiedades y comportamientos químicos.
¿Cómo se relaciona el número atómico con la configuración electrónica?
El número atómico determina la configuración electrónica de un elemento, es decir, la distribución de electrones en las capas alrededor del núcleo. Esta configuración es clave para entender la reactividad y las propiedades químicas del elemento.
¿Puede un elemento tener un número atómico negativo?
No, el número atómico siempre es un número entero positivo. Cada elemento tiene un número atómico que representa la cantidad de protones en su núcleo, y no puede ser negativo.
¿Qué es el número másico y cómo se diferencia del número atómico?
El número másico es la suma de protones y neutrones en el núcleo de un átomo, mientras que el número atómico solo cuenta los protones. Por lo tanto, el número másico puede variar entre isótopos de un mismo elemento, que tienen el mismo número atómico pero diferentes números de neutrones.