La química es una ciencia fascinante que nos ayuda a entender la composición, estructura y propiedades de la materia. En este contexto, el número atómico se convierte en una de las piezas clave para descifrar la naturaleza de los elementos químicos. ¿Te has preguntado alguna vez qué información te proporciona este número y por qué es tan crucial en el estudio de la química? En este artículo, exploraremos en profundidad el significado del número atómico, su importancia en la tabla periódica y cómo influye en las propiedades de los elementos. A medida que avancemos, descubrirás no solo su definición, sino también cómo se relaciona con conceptos fundamentales como la estructura atómica, la carga y el comportamiento químico. Así que prepárate para sumergirte en el mundo del número atómico y su relevancia en la química moderna.
¿Qué es el Número Atómico?
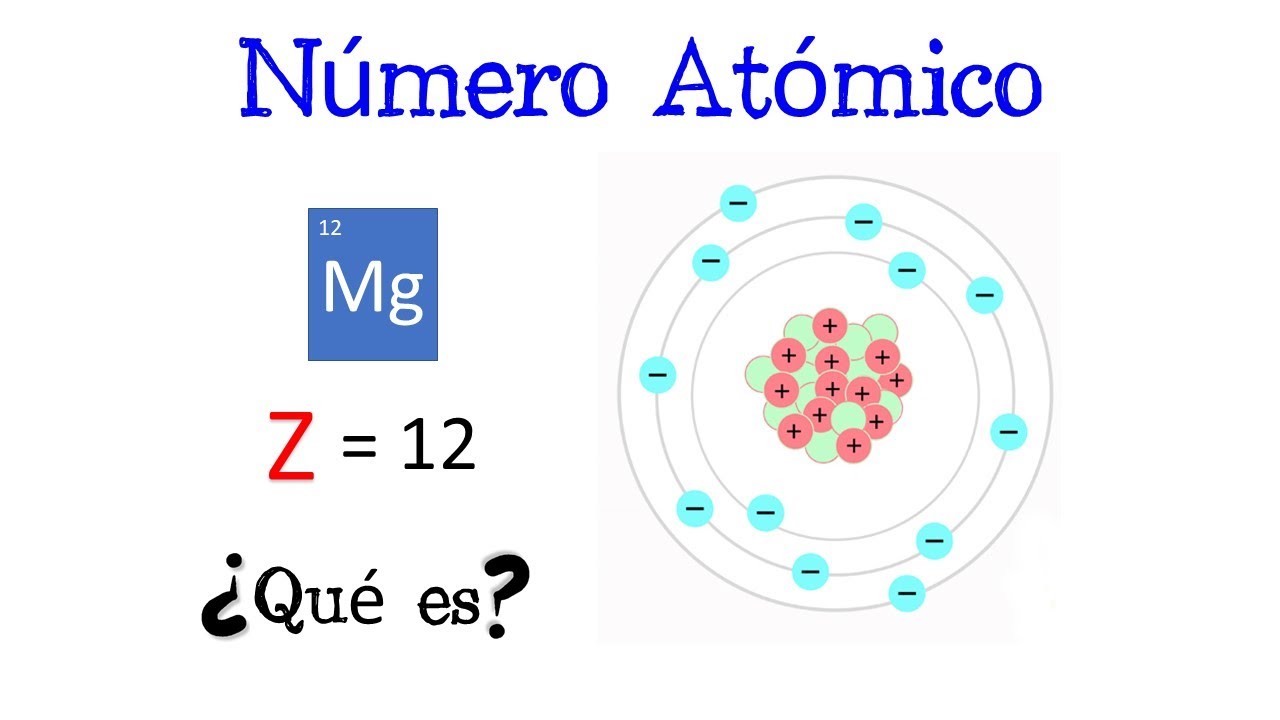
El número atómico, representado por la letra «Z», es un número entero que identifica a un elemento químico en la tabla periódica. Este número indica la cantidad de protones presentes en el núcleo de un átomo de dicho elemento. Por ejemplo, el hidrógeno, con un número atómico de 1, tiene un solo protón, mientras que el carbono, con un número atómico de 6, posee seis protones.
Protones y su Relación con el Número Atómico
Los protones son partículas subatómicas con carga positiva que se encuentran en el núcleo del átomo. La cantidad de protones en un átomo determina no solo el número atómico, sino también la identidad del elemento. Por lo tanto, el número atómico es fundamental para clasificar los elementos en la tabla periódica. Si un átomo pierde o gana protones, se convierte en un elemento diferente.
Además, el número atómico influye en la estabilidad del núcleo atómico. Elementos con un número atómico alto tienden a ser inestables y pueden experimentar desintegración radiactiva. Por lo tanto, entender el número atómico nos permite prever el comportamiento de los elementos en diversas reacciones químicas.
Ejemplos de Elementos y su Número Atómico
Para ilustrar la importancia del número atómico, consideremos algunos ejemplos:
1. Hidrógeno (H): Con un número atómico de 1, es el elemento más simple y ligero.
2. Oxígeno (O): Con un número atómico de 8, es esencial para la respiración de muchos organismos.
3. Hierro (Fe): Con un número atómico de 26, es un componente vital en la hemoglobina de la sangre.
Estos ejemplos muestran cómo el número atómico no solo define el elemento, sino que también nos da pistas sobre sus propiedades y su comportamiento en reacciones químicas.
La Tabla Periódica y el Número Atómico
La tabla periódica es una herramienta fundamental en la química, y el número atómico es su organizador principal. Cada elemento está dispuesto en orden creciente de número atómico, lo que permite identificar patrones en las propiedades de los elementos.
Organización de la Tabla Periódica
La tabla periódica no solo se organiza por número atómico, sino también en filas (períodos) y columnas (grupos). Los elementos en la misma columna comparten propiedades químicas similares. Por ejemplo, los elementos del grupo 1, como el litio (Li) y el sodio (Na), son metales alcalinos y tienen un comportamiento químico similar debido a su configuración electrónica.
Importancia de la Estructura Electrónica
El número atómico también está vinculado a la configuración electrónica de un elemento. A medida que aumenta el número atómico, los electrones se distribuyen en diferentes niveles de energía. Esta configuración electrónica es crucial para entender cómo un elemento interactúa químicamente con otros. Por ejemplo, los elementos con un número atómico más bajo tienden a ser más reactivos, mientras que los de número atómico más alto suelen ser más estables.
Propiedades Químicas Relacionadas con el Número Atómico
El número atómico no solo es un identificador; también tiene un impacto directo en las propiedades químicas de un elemento. La manera en que los átomos interactúan y forman compuestos depende en gran medida de su número atómico.
Reactividad Química
La reactividad de un elemento está influenciada por su número atómico y su configuración electrónica. Por ejemplo, los metales alcalinos, que se encuentran en el grupo 1 de la tabla periódica, son altamente reactivos. Esto se debe a que tienen un solo electrón en su capa de valencia, lo que les permite perderlo fácilmente en reacciones químicas.
En contraste, los gases nobles, que tienen números atómicos más altos y se encuentran en el grupo 18, son muy estables y poco reactivos. Su configuración electrónica completa les otorga una gran estabilidad, lo que les impide participar fácilmente en reacciones químicas.
Propiedades Físicas
El número atómico también puede influir en las propiedades físicas de los elementos, como el punto de fusión y ebullición, la densidad y el estado de la materia a temperatura ambiente. Por ejemplo, el helio (He), que tiene un número atómico de 2, es un gas a temperatura ambiente, mientras que el mercurio (Hg), con un número atómico de 80, es un líquido.
Isótopos y el Número Atómico
Los isótopos son variantes de un mismo elemento que tienen el mismo número atómico pero diferentes números de neutrones. Esto significa que, aunque los isótopos comparten el mismo número atómico, sus masas atómicas son diferentes.
Ejemplos de Isótopos
Un ejemplo común es el carbono, que tiene varios isótopos, siendo el más conocido el carbono-12 (12C) y el carbono-14 (14C). Ambos isótopos tienen un número atómico de 6, pero el carbono-12 tiene 6 neutrones, mientras que el carbono-14 tiene 8. Esta diferencia en neutrones da lugar a propiedades distintas, como la radiactividad del carbono-14, que se utiliza en datación arqueológica.
Aplicaciones de los Isótopos
Los isótopos tienen numerosas aplicaciones en campos como la medicina, la energía y la investigación científica. Por ejemplo, el uso de isótopos radiactivos en medicina permite diagnósticos y tratamientos más efectivos. Además, la datación con isótopos radiactivos ayuda a los científicos a entender la historia de la Tierra y la evolución de la vida.
El Número Atómico en la Investigación y la Industria
La comprensión del número atómico y su importancia se extiende más allá de la teoría química. En la investigación y la industria, el número atómico juega un papel crucial en diversas aplicaciones prácticas.
Desarrollo de Nuevos Materiales
Los científicos utilizan el conocimiento del número atómico para diseñar nuevos materiales. Por ejemplo, en la industria de los semiconductores, el número atómico de los elementos como el silicio (Si) y el germanio (Ge) es fundamental para el desarrollo de componentes electrónicos. La capacidad de manipular las propiedades de estos materiales a nivel atómico permite la creación de dispositivos más eficientes.
Aplicaciones en Energía Nuclear
El número atómico también es clave en el campo de la energía nuclear. Elementos como el uranio (U) y el plutonio (Pu) son utilizados en reactores nucleares debido a sus propiedades radiactivas, que dependen de su número atómico. La comprensión de cómo estos elementos interactúan a nivel atómico es vital para el desarrollo de tecnologías nucleares seguras y efectivas.
¿Qué sucede si un átomo cambia su número atómico?
Si un átomo cambia su número atómico, se convierte en un elemento diferente. Esto ocurre cuando se añaden o eliminan protones del núcleo. Por ejemplo, si un átomo de carbono (número atómico 6) pierde un protón, se convierte en boro (número atómico 5).
¿Por qué el número atómico es importante en la química?
El número atómico es fundamental porque determina la identidad de un elemento y sus propiedades químicas. También es crucial para entender cómo los elementos interactúan entre sí y forman compuestos.
¿Cómo se relaciona el número atómico con la masa atómica?
El número atómico indica la cantidad de protones en un átomo, mientras que la masa atómica es la suma de protones y neutrones. Por lo tanto, dos isótopos del mismo elemento pueden tener el mismo número atómico pero diferentes masas atómicas debido a la variación en el número de neutrones.
¿Qué son los isótopos y por qué son importantes?
Los isótopos son variantes de un elemento que tienen el mismo número atómico pero diferentes números de neutrones. Son importantes en aplicaciones como la medicina y la datación científica, ya que su comportamiento radiactivo puede ser utilizado para diagnosticar enfermedades o determinar la edad de fósiles.
¿Cómo se utiliza el número atómico en la tabla periódica?
En la tabla periódica, los elementos están organizados en orden creciente de número atómico. Esto permite identificar patrones en las propiedades de los elementos y facilita la comprensión de sus comportamientos químicos.
¿El número atómico afecta el estado de un elemento a temperatura ambiente?
Sí, el número atómico puede influir en el estado de un elemento a temperatura ambiente. Elementos con un número atómico más bajo, como el helio, son gases, mientras que aquellos con un número atómico más alto, como el mercurio, son líquidos a temperatura ambiente.
¿Puede un elemento tener el mismo número atómico y diferentes propiedades?
No, un elemento con un número atómico específico tiene propiedades únicas. Sin embargo, los isótopos de un mismo elemento pueden tener diferentes propiedades físicas y químicas debido a su distinto número de neutrones.