La solubilidad en agua es un fenómeno fascinante que afecta nuestra vida cotidiana más de lo que imaginamos. Desde la disolución de sal en agua para preparar alimentos hasta la manera en que los medicamentos se absorben en nuestro cuerpo, la comprensión de este concepto es crucial. Uno de los aspectos más importantes que influye en la solubilidad es el tipo de enlace químico que presentan las moléculas. En este contexto, el enlace covalente polar juega un papel fundamental. Este artículo explorará a fondo cómo el enlace covalente polar impacta la solubilidad en agua, brindándote una comprensión completa de su relevancia en la química y su aplicación en la vida diaria. Prepárate para descubrir cómo estas interacciones moleculares afectan todo, desde la naturaleza de las sustancias hasta los procesos biológicos en nuestro organismo.
¿Qué es la Solubilidad en Agua?
La solubilidad en agua se refiere a la capacidad de una sustancia para disolverse en agua, formando una solución homogénea. Este proceso depende de varios factores, como la temperatura, la presión y, por supuesto, la naturaleza de las moléculas involucradas. Pero, ¿qué significa realmente que algo sea soluble en agua? Para entenderlo, es esencial analizar cómo interactúan las moléculas de soluto (la sustancia que se disuelve) con las moléculas de solvente (el agua).
Definición y Conceptos Básicos
La solubilidad se puede definir cuantitativamente como la cantidad máxima de soluto que puede disolverse en un volumen determinado de solvente a una temperatura específica. Esta propiedad es crucial en muchas aplicaciones, desde la formulación de productos químicos hasta la biología y la farmacología. Por ejemplo, en el caso del azúcar, su alta solubilidad en agua se debe a su estructura molecular, que permite interacciones favorables con las moléculas de agua.
La solubilidad se mide generalmente en gramos de soluto por litro de solvente (g/L). Sin embargo, no todas las sustancias son igualmente solubles en agua. Algunas son altamente solubles, como el cloruro de sodio, mientras que otras, como el aceite, son prácticamente insolubles. Esto se debe a la polaridad de las moléculas y la naturaleza de sus enlaces químicos.
Factores que Afectan la Solubilidad
Varios factores pueden influir en la solubilidad de una sustancia en agua, entre ellos:
- Polaridad: Las moléculas polares tienden a ser más solubles en agua debido a las interacciones electrostáticas favorables.
- Temperatura: En general, la solubilidad de sólidos en líquidos aumenta con la temperatura, mientras que la de gases puede disminuir.
- Presión: La presión afecta principalmente la solubilidad de gases; a mayor presión, mayor solubilidad.
Entender estos factores es esencial para manipular y predecir la solubilidad de diferentes compuestos en diversas aplicaciones científicas y cotidianas.
El Enlace Covalente Polar: Una Clave para la Solubilidad
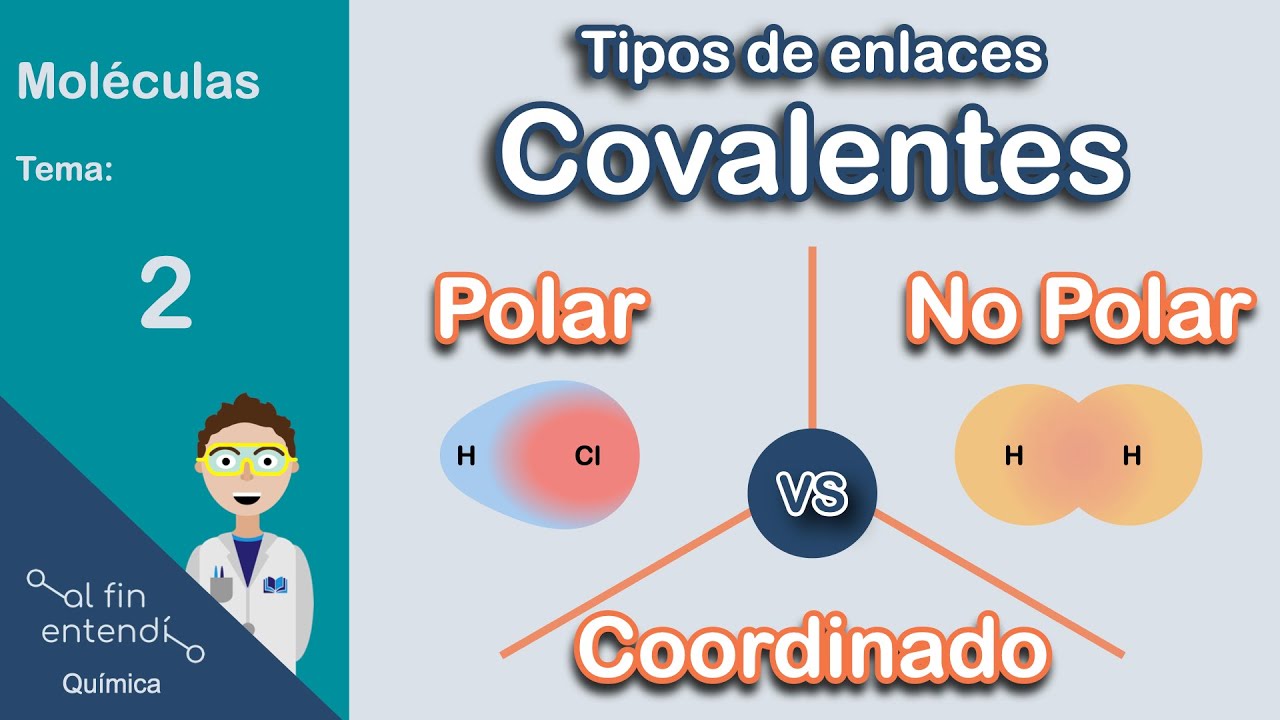
Para comprender la solubilidad en agua, es fundamental conocer el enlace covalente polar. Este tipo de enlace se forma cuando dos átomos comparten electrones de manera desigual, resultando en una distribución de carga que crea un dipolo eléctrico. Esta polaridad es lo que permite que ciertas moléculas se disuelvan en agua, mientras que otras no.
¿Qué es un Enlace Covalente Polar?
Un enlace covalente polar ocurre entre átomos que tienen diferentes electronegatividades. La electronegatividad es la capacidad de un átomo para atraer electrones hacia sí mismo. Cuando dos átomos con diferentes electronegatividades se combinan, el átomo más electronegativo atraerá los electrones compartidos con más fuerza, creando una carga parcial negativa en ese átomo y una carga parcial positiva en el otro.
Un ejemplo clásico de un enlace covalente polar es el agua (H₂O). En la molécula de agua, el oxígeno es más electronegativo que el hidrógeno, lo que resulta en una distribución desigual de electrones. Esto le confiere a la molécula de agua sus propiedades únicas, incluyendo su capacidad para disolver otras sustancias.
Características del Enlace Covalente Polar
Las características del enlace covalente polar son fundamentales para entender cómo se produce la solubilidad. Algunas de ellas son:
- Dipolos eléctricos: La formación de dipolos eléctricos permite interacciones con otras moléculas polares y iones, facilitando la disolución.
- Interacciones intermoleculares: Las moléculas polares pueden formar enlaces de hidrógeno, lo que aumenta aún más su solubilidad en agua.
- Solvatación: Cuando una sustancia se disuelve en agua, las moléculas de agua rodean las partículas de soluto, estabilizándolas y evitando que se vuelvan a agrupar.
Estas características hacen que las moléculas polares sean más propensas a disolverse en agua, mientras que las moléculas no polares, que no tienen un dipolo, tienden a ser insolubles.
La Relación entre Polaridad y Solubilidad
La relación entre la polaridad de una molécula y su solubilidad en agua es fundamental en química. Como regla general, «lo similar disuelve a lo similar». Esto significa que las moléculas polares se disuelven bien en solventes polares como el agua, mientras que las moléculas no polares se disuelven en solventes no polares.
Ejemplos de Solubilidad Basados en Polaridad
Para ilustrar esta relación, consideremos algunos ejemplos:
- Cloruro de sodio (NaCl): Este compuesto iónico se disuelve fácilmente en agua. Las moléculas de agua rodean los iones Na+ y Cl–, separándolos y permitiendo su disolución.
- Azúcar (C12H22O11): Al ser una molécula polar, el azúcar se disuelve bien en agua, formando enlaces de hidrógeno con las moléculas de agua.
- Grasas y aceites: Estas sustancias son principalmente no polares y, por lo tanto, son insolubles en agua. No pueden formar interacciones favorables con las moléculas de agua, lo que les impide disolverse.
Estos ejemplos resaltan cómo la polaridad de una sustancia determina su comportamiento en un medio acuoso, lo que es crucial en muchas aplicaciones prácticas.
Consecuencias de la Polaridad en Procesos Biológicos
La polaridad y la solubilidad tienen un impacto significativo en procesos biológicos. Por ejemplo, las proteínas y los ácidos nucleicos tienen estructuras que dependen de la polaridad de sus componentes. Las interacciones entre las moléculas de agua y estas biomoléculas son esenciales para mantener la estructura y función celular.
Además, la solubilidad de los medicamentos en agua influye en su eficacia. Los fármacos diseñados para ser solubles en agua pueden ser absorbidos más fácilmente por el organismo, lo que aumenta su biodisponibilidad y eficacia terapéutica. Por lo tanto, la polaridad y la solubilidad son factores clave en la farmacología y la biología molecular.
Aplicaciones Prácticas de la Solubilidad en Agua
La comprensión de la solubilidad en agua y del enlace covalente polar tiene múltiples aplicaciones prácticas en la vida cotidiana, la industria y la investigación científica. Desde la cocina hasta la medicina, estas interacciones moleculares son fundamentales.
En la Industria Alimentaria
En la industria alimentaria, la solubilidad es crucial para la formulación de productos. Por ejemplo, al preparar bebidas, es esencial que los azúcares y sabores sean solubles en agua para asegurar una mezcla homogénea. La polaridad de los ingredientes determina su capacidad para disolverse y, por lo tanto, influye en el sabor y la textura del producto final.
Además, la solubilidad afecta la conservación de los alimentos. Algunos conservantes son solubles en agua y se utilizan para prolongar la vida útil de los productos. La comprensión de la solubilidad permite a los científicos desarrollar nuevas técnicas de conservación que mejoren la calidad y seguridad de los alimentos.
En la Medicina y Farmacología
En el ámbito médico, la solubilidad de los medicamentos es un factor crítico. Los fármacos deben ser solubles en agua para ser eficaces en el cuerpo. Esto se debe a que, una vez ingeridos, los medicamentos deben disolverse en el líquido corporal para ser absorbidos por el sistema. Por lo tanto, la investigación sobre la solubilidad de nuevas moléculas es un paso esencial en el desarrollo de tratamientos eficaces.
Además, los avances en la formulación de medicamentos han llevado al desarrollo de tecnologías que mejoran la solubilidad de compuestos poco solubles, lo que puede aumentar la eficacia de los tratamientos para diversas enfermedades.
En la Investigación Científica
La solubilidad en agua también es un tema de interés en la investigación científica. Los científicos estudian cómo las propiedades de solubilidad afectan reacciones químicas y procesos biológicos. Por ejemplo, en la investigación sobre el cambio climático, se analiza cómo la solubilidad de gases en agua influye en la acidificación de los océanos.
Además, en el campo de la biotecnología, la comprensión de la solubilidad es vital para el desarrollo de nuevos bioprocesos que utilizan microorganismos para producir compuestos útiles. La solubilidad de los sustratos y productos finales puede afectar la eficiencia de estas reacciones, lo que hace que su estudio sea esencial para optimizar procesos industriales.
Desafíos y Oportunidades en la Solubilidad
A pesar de los avances en la comprensión de la solubilidad en agua, todavía existen desafíos en este campo. La solubilidad de muchos compuestos sigue siendo limitada, lo que puede obstaculizar su uso en diversas aplicaciones. Sin embargo, estos desafíos también presentan oportunidades para la investigación y el desarrollo.
Compuestos Poco Solubles
Los compuestos poco solubles representan un desafío significativo en varias áreas, incluida la farmacología. Muchos medicamentos potenciales tienen baja solubilidad en agua, lo que limita su eficacia. Por lo tanto, la investigación se centra en encontrar métodos para mejorar la solubilidad de estos compuestos. Esto puede incluir la modificación química de la estructura del fármaco o el uso de aditivos que mejoren su disolución.
Además, la nanotecnología ha emergido como una herramienta prometedora para abordar estos problemas. A través de la ingeniería de nanopartículas, los científicos pueden mejorar la solubilidad de compuestos difíciles de disolver, lo que podría abrir nuevas vías para el desarrollo de medicamentos y tratamientos.
Innovaciones en Formulación
La industria también está innovando en la formulación de productos para mejorar la solubilidad. Las técnicas de microencapsulación y el uso de excipientes que facilitan la disolución son áreas de investigación activa. Estas innovaciones no solo benefician la farmacología, sino que también tienen aplicaciones en la industria alimentaria y cosmética.
En este contexto, es fundamental que los investigadores y profesionales continúen explorando nuevas estrategias para abordar los desafíos de la solubilidad y aprovechar las oportunidades que surgen de estos problemas.
¿Por qué algunas sustancias son más solubles en agua que otras?
La solubilidad de una sustancia en agua depende de su polaridad. Las moléculas polares, como el azúcar y la sal, se disuelven bien en agua debido a las interacciones favorables con las moléculas de agua. En contraste, las moléculas no polares, como el aceite, no pueden interactuar adecuadamente con el agua, lo que resulta en baja solubilidad.
¿Qué papel juega la temperatura en la solubilidad?
La temperatura puede afectar la solubilidad de los sólidos y gases en líquidos. En general, a medida que la temperatura aumenta, la solubilidad de los sólidos en agua también aumenta. Sin embargo, para los gases, la solubilidad tiende a disminuir con el aumento de la temperatura. Esto se debe a que el aumento de temperatura proporciona más energía a las moléculas, lo que facilita la escape de las moléculas de gas del líquido.