La Tabla Periódica de los Elementos es una de las herramientas más fundamentales en la química y la ciencia en general. No solo organiza los elementos químicos de manera lógica, sino que también proporciona información crucial, como la masa atómica de cada elemento. Entender la masa atómica no es solo una cuestión de números; es clave para comprender cómo interactúan los elementos entre sí y cómo se comportan en diferentes reacciones químicas. En este artículo, exploraremos en profundidad qué es la masa atómica, cómo se calcula, su importancia en la química y un análisis detallado de algunos elementos clave. Además, responderemos a preguntas frecuentes para aclarar cualquier duda que puedas tener sobre este tema fascinante.
¿Qué es la Masa Atómica?
La masa atómica es un concepto fundamental en la química que se refiere a la masa promedio de los átomos de un elemento, medida en unidades de masa atómica (uma). Este valor no corresponde a un número entero debido a que se calcula a partir de la abundancia relativa de los isótopos de un elemento en la naturaleza. Por lo tanto, la masa atómica se convierte en un promedio ponderado que refleja tanto la masa de los isótopos como su proporción en la naturaleza.
Definición y Unidades
La unidad de masa atómica, o uma, es una medida que se utiliza para expresar la masa de átomos y moléculas. Un uma se define como un doceava parte de la masa de un átomo de carbono-12, que se considera el estándar para estas mediciones. Así, cuando se dice que el hidrógeno tiene una masa atómica de aproximadamente 1.008 uma, se está diciendo que, en promedio, los átomos de hidrógeno son un poco más de una unidad de masa atómica. Este sistema de unidades permite a los científicos realizar cálculos precisos en química, física y biología.
Isótopos y Masa Atómica
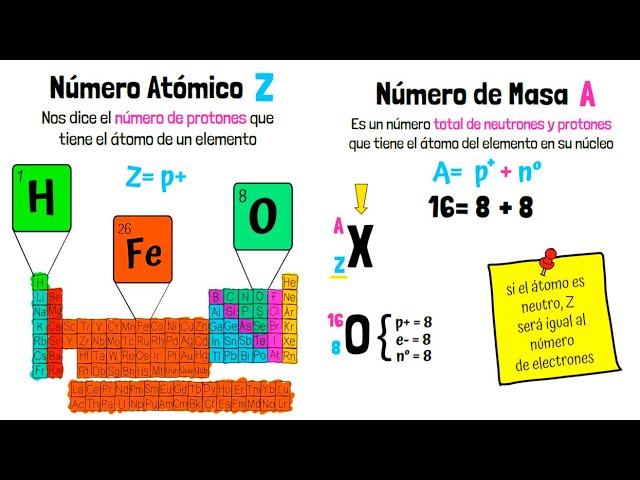
La masa atómica de un elemento no es un número entero porque muchos elementos tienen isótopos, que son átomos del mismo elemento que tienen el mismo número de protones pero diferentes números de neutrones. Por ejemplo, el carbono tiene isótopos como el carbono-12 y el carbono-14. Mientras que el carbono-12 tiene una masa de 12 uma, el carbono-14 tiene una masa de 14 uma. La masa atómica promedio que se encuentra en la tabla periódica toma en cuenta la proporción de cada isótopo en la naturaleza, lo que resulta en un número que puede ser decimal.
¿Cómo se Calcula la Masa Atómica?
El cálculo de la masa atómica de un elemento es un proceso que implica conocer la masa y la abundancia relativa de sus isótopos. Este proceso puede parecer complicado, pero se puede simplificar en algunos pasos clave. Primero, es importante identificar todos los isótopos de un elemento y sus respectivas masas. Luego, se multiplica la masa de cada isótopo por su abundancia relativa y se suman todos estos valores. El resultado final es la masa atómica promedio del elemento.
Ejemplo de Cálculo: El Carbono
Tomemos el carbono como ejemplo. Este elemento tiene tres isótopos principales: carbono-12, carbono-13 y carbono-14. Supongamos que la abundancia relativa es la siguiente:
- Carbono-12: 98.89%
- Carbono-13: 1.11%
- Carbono-14: Muy escaso y se ignora en el cálculo de masa atómica promedio.
La masa atómica se calcula de la siguiente manera:
Masa atómica = (12 uma * 0.9889) + (13 uma * 0.0111)
= 11.867 + 0.1443
= 12.0113 uma
Así, el valor que vemos en la tabla periódica para el carbono es aproximadamente 12.01 uma, que refleja su masa atómica promedio considerando la abundancia de sus isótopos.
Errores Comunes en el Cálculo
Es fundamental prestar atención a algunos errores comunes al calcular la masa atómica. Uno de los errores más frecuentes es no considerar la abundancia de todos los isótopos, especialmente aquellos que son menos comunes. También es importante asegurarse de utilizar las masas atómicas correctas de los isótopos, ya que cualquier error en estos valores puede llevar a un cálculo incorrecto. Por último, al redondear los números, es crucial hacerlo de manera que no afecte la precisión del resultado final.
Importancia de la Masa Atómica en la Química
La masa atómica juega un papel crucial en diversas áreas de la química. Desde el cálculo de fórmulas químicas hasta la estequiometría en reacciones químicas, la masa atómica es una herramienta esencial. Sin ella, sería imposible predecir cómo se comportarán los elementos en una reacción o cómo se formarán compuestos químicos.
Estequiometría y Reacciones Químicas
La estequiometría es el estudio de las relaciones cuantitativas en las reacciones químicas. Utiliza la masa atómica para determinar cuántos moles de un reactivo se necesitan para reaccionar con un número determinado de moles de otro reactivo. Por ejemplo, si estamos trabajando con la reacción entre hidrógeno y oxígeno para formar agua, necesitamos conocer la masa atómica de ambos elementos para calcular la cantidad necesaria de cada uno. Sin esta información, no podríamos realizar predicciones precisas sobre la cantidad de productos que se generarán.
Compuestos y Fórmulas Químicas
Cuando se forman compuestos, la masa atómica de los elementos involucrados se utiliza para calcular la masa molecular del compuesto. Por ejemplo, el agua (H₂O) tiene una masa molecular que se calcula sumando las masas atómicas de sus componentes: dos átomos de hidrógeno y un átomo de oxígeno. Esto es vital no solo para entender la composición de los compuestos, sino también para aplicar esta información en diferentes contextos, como la biología y la medicina.
Aplicaciones en Investigación y Desarrollo
En el ámbito de la investigación, la masa atómica es fundamental para el desarrollo de nuevos materiales y medicamentos. Por ejemplo, en la síntesis de fármacos, los químicos deben conocer las masas atómicas de los compuestos que están creando para predecir cómo se comportarán en el cuerpo humano. Además, en la investigación de nuevos materiales, como los semiconductores, la masa atómica puede influir en las propiedades eléctricas y térmicas de los materiales, lo que es crucial para el diseño de dispositivos electrónicos.
Un Vistazo a la Tabla Periódica y sus Elementos
La Tabla Periódica de los Elementos no solo muestra la masa atómica, sino que también organiza los elementos de acuerdo a sus propiedades químicas y físicas. Cada elemento tiene su lugar en esta tabla, y su posición está relacionada con su estructura atómica y comportamiento en reacciones químicas.
Estructura de la Tabla Periódica
La Tabla Periódica está organizada en filas y columnas. Las filas, llamadas períodos, representan el número de capas de electrones en los átomos de los elementos. Las columnas, conocidas como grupos o familias, agrupan elementos que tienen propiedades similares. Por ejemplo, todos los elementos en el grupo 1 son metales alcalinos y tienen una valencia de +1, lo que significa que tienden a perder un electrón en reacciones químicas.
Ejemplos de Elementos y sus Masas Atómicas
Para ilustrar la variedad de elementos y sus masas atómicas, consideremos algunos ejemplos destacados:
- Hidrógeno (H): Masa atómica de aproximadamente 1.008 uma, es el elemento más ligero y el más abundante en el universo.
- Oxígeno (O): Con una masa atómica de 16.00 uma, es esencial para la vida y juega un papel crucial en la respiración celular.
- Hierro (Fe): Con una masa atómica de 55.85 uma, es un metal fundamental en la industria y en la biología, siendo esencial para la formación de hemoglobina en la sangre.
- Uranio (U): Masa atómica de 238.03 uma, es conocido por su uso en energía nuclear y armamento.
Estos ejemplos muestran cómo la masa atómica varía ampliamente entre los elementos y cómo esta variabilidad influye en sus propiedades y aplicaciones.
¿Por qué la masa atómica de algunos elementos no es un número entero?
La masa atómica de un elemento no es un número entero debido a la existencia de isótopos. Los isótopos son átomos del mismo elemento que tienen diferentes números de neutrones, lo que resulta en diferentes masas. La masa atómica promedio que se muestra en la tabla periódica es un promedio ponderado de todos los isótopos de un elemento, considerando su abundancia relativa en la naturaleza.
¿Cómo se relaciona la masa atómica con la reactividad de un elemento?
La masa atómica por sí sola no determina la reactividad de un elemento, pero puede influir en cómo se comporta en reacciones químicas. Por ejemplo, los elementos con masas atómicas más bajas tienden a ser más reactivos, como los metales alcalinos. Sin embargo, otros factores como la estructura electrónica y la configuración de electrones también son cruciales para entender la reactividad de un elemento.
¿Qué papel juega la masa atómica en la química orgánica?
En la química orgánica, la masa atómica es esencial para calcular la masa molecular de compuestos, lo que a su vez es crucial para la estequiometría en reacciones químicas. Además, la masa atómica ayuda a los químicos a entender las propiedades de los compuestos orgánicos y cómo se comportan en diferentes condiciones.
¿Puede la masa atómica cambiar con el tiempo?
La masa atómica de un elemento en la tabla periódica es constante, ya que se basa en las propiedades intrínsecas de sus isótopos. Sin embargo, la abundancia relativa de los isótopos puede cambiar en ciertos contextos, como en reacciones nucleares, lo que podría afectar el valor promedio de la masa atómica en situaciones específicas, aunque esto no es común en condiciones normales.
¿Por qué es importante conocer la masa atómica de un elemento en la industria?
Conocer la masa atómica es fundamental en la industria para procesos de producción, formulación de productos y control de calidad. Por ejemplo, en la fabricación de productos químicos, la precisión en las proporciones de los reactivos basadas en sus masas atómicas es esencial para asegurar la eficiencia y la seguridad de los procesos. Además, en la industria farmacéutica, es vital para desarrollar y producir medicamentos efectivos.
¿Qué es la masa molecular y cómo se relaciona con la masa atómica?
La masa molecular es la suma de las masas atómicas de todos los átomos en una molécula. Es un concepto que se utiliza para entender la composición de compuestos y su comportamiento en reacciones químicas. Por ejemplo, la masa molecular del agua se calcula sumando las masas atómicas del hidrógeno y el oxígeno. Mientras que la masa atómica se refiere a un solo elemento, la masa molecular se refiere a la combinación de varios elementos en una molécula.
¿Dónde se puede encontrar información sobre la masa atómica de los elementos?
La información sobre la masa atómica de los elementos se encuentra en la Tabla Periódica, que se puede encontrar en libros de texto de química, en línea y en recursos educativos. Además, las tablas periódicas modernas incluyen información adicional como el número atómico, la configuración electrónica y las propiedades físicas y químicas de los elementos.