La estructura tridimensional de las proteínas es uno de los aspectos más fascinantes y complejos de la biología molecular. Desde la manera en que se pliegan hasta cómo interactúan con otras biomoléculas, la forma de una proteína es fundamental para su función. Este artículo te llevará a través de los diferentes niveles de organización de las proteínas, explorando cómo cada uno contribuye a su estabilidad y actividad biológica. Aprenderemos sobre los enlaces químicos que mantienen la estructura, la importancia de la desnaturalización y cómo la estructura tridimensional se relaciona con enfermedades. Además, analizaremos ejemplos concretos y su relevancia en el mundo real, desde la medicina hasta la biotecnología. Prepárate para sumergirte en un mundo donde la forma y la función se entrelazan de manera intrincada y fascinante.
Niveles de Estructura de las Proteínas
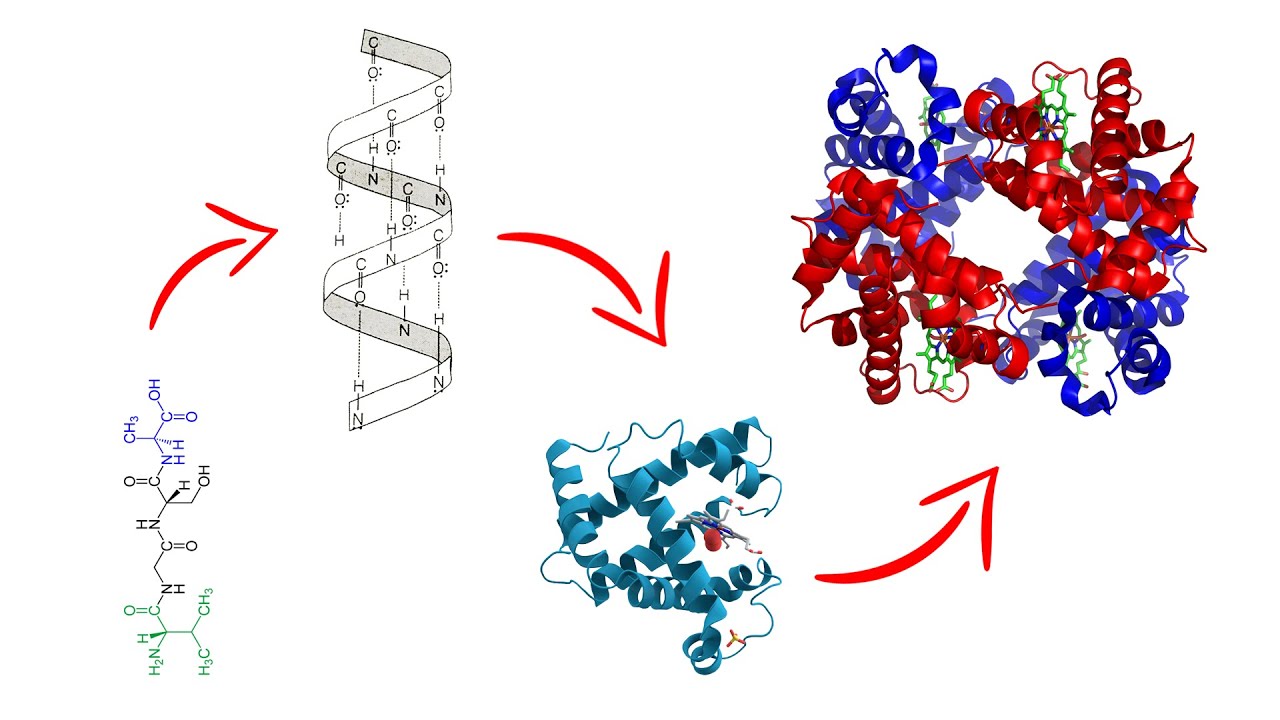
Para entender la estructura tridimensional de las proteínas, primero es esencial conocer los cuatro niveles de organización que las componen: estructura primaria, secundaria, terciaria y cuaternaria. Cada uno de estos niveles representa un aspecto diferente del plegamiento y la organización de las cadenas de aminoácidos que forman las proteínas.
Estructura Primaria
La estructura primaria de una proteína se refiere a la secuencia lineal de aminoácidos que la componen. Esta secuencia es crucial, ya que determina cómo se pliega la proteína en sus formas más complejas. Cada aminoácido en la cadena está unido a sus vecinos por enlaces peptídicos, formando una cadena polipeptídica. La secuencia específica de aminoácidos es codificada por el ADN y, por lo tanto, cualquier cambio en esta secuencia puede afectar drásticamente la función de la proteína.
Por ejemplo, en la hemoglobina, una proteína esencial para el transporte de oxígeno en la sangre, un solo cambio en la secuencia de aminoácidos puede llevar a condiciones como la anemia falciforme. En este caso, un aminoácido es sustituido, lo que provoca que las moléculas de hemoglobina se plieguen de manera anormal, afectando su capacidad para transportar oxígeno.
Estructura Secundaria
La estructura secundaria se refiere a las conformaciones locales que pueden adoptar las cadenas polipeptídicas, como hélices alfa y láminas beta. Estas estructuras son estabilizadas principalmente por enlaces de hidrógeno entre los grupos amida de la cadena polipeptídica. Las hélices alfa son estructuras en espiral que pueden encontrarse en muchas proteínas, mientras que las láminas beta consisten en cadenas de aminoácidos que se alinean paralelamente, formando una hoja plegada.
Un ejemplo clásico de estructura secundaria es la queratina, una proteína que se encuentra en el cabello y las uñas. La queratina tiene muchas hélices alfa, lo que le confiere una gran resistencia y elasticidad. Por lo tanto, entender la estructura secundaria es crucial para apreciar cómo las proteínas pueden tener propiedades físicas específicas basadas en su conformación.
Estructura Terciaria: El Plegado Completo
La estructura terciaria es el resultado del plegamiento tridimensional completo de una proteína, donde se forman interacciones más complejas entre las diferentes cadenas laterales de los aminoácidos. Estas interacciones pueden incluir enlaces iónicos, interacciones hidrofóbicas, puentes de disulfuro y enlaces de hidrógeno. Este nivel de organización es fundamental, ya que la forma tridimensional de la proteína influye directamente en su función.
Interacciones en la Estructura Terciaria
Las interacciones que estabilizan la estructura terciaria son diversas. Las interacciones hidrofóbicas, por ejemplo, tienden a ocurrir entre los aminoácidos que son no polares, mientras que los aminoácidos polares o cargados tienden a interactuar con el agua. Esto significa que en un entorno acuoso, los aminoácidos hidrofóbicos se agrupan en el interior de la proteína, mientras que los hidrofílicos permanecen en la superficie.
Un buen ejemplo de esto es la mioglobina, que es responsable del almacenamiento de oxígeno en los músculos. Su estructura terciaria permite que la proteína se una al oxígeno de manera eficiente, asegurando que el oxígeno esté disponible cuando los músculos lo necesitan. Así, la estructura terciaria no solo es vital para la estabilidad, sino que también es clave para la función biológica de la proteína.
Importancia del Plegado Correcto
El correcto plegado de las proteínas es esencial para su funcionalidad. Cuando una proteína no se pliega correctamente, puede llevar a la pérdida de función y, en algunos casos, a enfermedades. Las enfermedades priónicas, como el mal de Creutzfeldt-Jakob, son ejemplos extremos de cómo el plegamiento incorrecto puede tener consecuencias devastadoras. En estas enfermedades, una proteína mal plegada induce a otras proteínas a adoptar la misma conformación errónea, propagando la patología.
Estructura Cuaternaria: La Unión de Subunidades
La estructura cuaternaria se refiere a la combinación de dos o más cadenas polipeptídicas (subunidades) para formar una proteína funcional. No todas las proteínas tienen estructura cuaternaria; aquellas que sí, suelen ser proteínas que requieren la cooperación de múltiples subunidades para llevar a cabo su función. Un ejemplo clásico es la hemoglobina, que está compuesta por cuatro subunidades que trabajan juntas para transportar oxígeno.
Ejemplos de Proteínas con Estructura Cuaternaria
Además de la hemoglobina, otras proteínas con estructura cuaternaria incluyen la insulina y los anticuerpos. La insulina, que regula los niveles de glucosa en sangre, está formada por dos cadenas polipeptídicas unidas por enlaces disulfuro. Por su parte, los anticuerpos, que son cruciales para el sistema inmunológico, tienen varias subunidades que les permiten reconocer y neutralizar patógenos.
La colaboración entre subunidades en la estructura cuaternaria es esencial para la función de estas proteínas. La interacción entre las diferentes cadenas permite que la proteína responda a cambios en su entorno, asegurando una respuesta biológica adecuada y eficiente.
Impacto de la Desnaturalización
La desnaturalización es el proceso por el cual una proteína pierde su estructura tridimensional, lo que resulta en la pérdida de su función. Este fenómeno puede ser causado por factores como cambios en la temperatura, pH o la presencia de agentes químicos. Por ejemplo, al calentar un huevo, la clara se coagula y cambia de estado líquido a sólido debido a la desnaturalización de las proteínas presentes. Este proceso es un recordatorio de cuán frágiles y sensibles pueden ser las estructuras proteicas.
Relación entre Estructura y Función
La conexión entre la estructura tridimensional de las proteínas y su función es un tema central en la biología. La forma de una proteína no solo determina cómo se pliega, sino también cómo interactúa con otras moléculas. Esta relación es fundamental para entender procesos biológicos como la catalización enzimática, la señalización celular y la respuesta inmune.
Catalizadores Biológicos: Las Enzimas
Las enzimas son proteínas que actúan como catalizadores en reacciones bioquímicas. Su actividad depende de su estructura tridimensional, que crea un sitio activo donde se lleva a cabo la reacción. Por ejemplo, la enzima lactasa descompone la lactosa en glucosa y galactosa. La forma específica del sitio activo de la lactasa es lo que le permite reconocer y unirse a la lactosa, facilitando su transformación.
Un cambio en la estructura de la enzima, ya sea por mutaciones genéticas o por desnaturalización, puede resultar en una disminución o pérdida de actividad enzimática. Este fenómeno es observable en diversas enfermedades metabólicas, donde la incapacidad de las enzimas para funcionar correctamente conduce a la acumulación de metabolitos dañinos.
Interacciones Moleculares en la Señalización Celular
La señalización celular es otro campo donde la estructura de las proteínas juega un papel crucial. Las proteínas receptoras en la superficie de las células tienen estructuras específicas que les permiten reconocer y unirse a moléculas señalizadoras, como hormonas o neurotransmisores. Este reconocimiento es esencial para la comunicación entre células y la regulación de procesos fisiológicos.
Por ejemplo, el receptor de insulina es una proteína que, al unirse a la insulina, activa una cascada de señales que permite la captación de glucosa en las células. Si la estructura de este receptor se ve alterada, la señalización se interrumpe, lo que puede llevar a enfermedades como la diabetes tipo 2.
Aplicaciones Prácticas y Avances en la Investigación
La comprensión de la estructura tridimensional de las proteínas ha llevado a avances significativos en diversos campos, incluyendo la medicina y la biotecnología. El desarrollo de fármacos basados en la estructura de proteínas específicas ha revolucionado el tratamiento de enfermedades.
Diseño de Fármacos Basado en Estructura
El diseño de fármacos basado en la estructura, también conocido como diseño de fármacos in silico, utiliza modelos tridimensionales de proteínas para identificar compuestos que pueden unirse a sitios activos específicos. Este enfoque ha permitido el desarrollo de medicamentos más eficaces y específicos, reduciendo efectos secundarios no deseados.
Un ejemplo notable es el desarrollo de inhibidores de proteasas para el tratamiento del VIH. Estos fármacos se diseñan para encajar en el sitio activo de la proteasa viral, bloqueando su función y, por ende, la replicación del virus. La comprensión de la estructura tridimensional de la proteasa ha sido fundamental en este proceso.
Biotecnología y Terapias Basadas en Proteínas
La biotecnología también se beneficia enormemente de la comprensión de la estructura de las proteínas. Las terapias basadas en proteínas, como las hormonas recombinantes y los anticuerpos monoclonales, son ejemplos de cómo la ingeniería de proteínas puede tener un impacto positivo en la salud humana. Estas terapias se diseñan para replicar o mejorar funciones biológicas específicas, ofreciendo tratamientos para enfermedades que antes carecían de opciones efectivas.
¿Qué factores pueden afectar la estructura tridimensional de una proteína?
La estructura tridimensional de una proteína puede verse afectada por varios factores, incluidos cambios en la temperatura, el pH y la concentración de sales. Estos factores pueden causar desnaturalización, donde la proteína pierde su conformación nativa y, por lo tanto, su funcionalidad. Por ejemplo, un aumento en la temperatura puede romper los enlaces de hidrógeno que estabilizan la estructura, llevando a la pérdida de actividad biológica.
¿Por qué es importante la estructura cuaternaria en las proteínas?
La estructura cuaternaria es crucial porque permite que múltiples subunidades trabajen juntas para realizar funciones específicas. La interacción entre estas subunidades puede ser esencial para la actividad biológica de la proteína. Por ejemplo, en la hemoglobina, la cooperación entre sus cuatro subunidades es necesaria para el transporte eficiente de oxígeno en la sangre.
¿Cómo se determina la estructura tridimensional de una proteína?
La estructura tridimensional de una proteína se puede determinar utilizando técnicas como la cristalografía de rayos X, la resonancia magnética nuclear (RMN) y la microscopía crioelectrónica. Estas técnicas permiten visualizar la disposición de los átomos en la proteína y entender cómo su estructura se relaciona con su función. Cada método tiene sus ventajas y limitaciones, pero en conjunto han proporcionado una comprensión profunda de la biología molecular.
¿Qué sucede si una proteína no se pliega correctamente?
Si una proteína no se pliega correctamente, puede resultar en una pérdida de función y, en algunos casos, provocar enfermedades. Las proteínas mal plegadas pueden acumularse en las células, llevando a condiciones como enfermedades neurodegenerativas. La correcta interacción entre la secuencia de aminoácidos y el ambiente celular es esencial para asegurar que las proteínas adopten su conformación adecuada.
¿Qué papel juegan las chaperonas en el plegamiento de proteínas?
Las chaperonas son proteínas que ayudan en el plegamiento correcto de otras proteínas. Actúan evitando que las proteínas recién sintetizadas se agreguen incorrectamente y proporcionan un ambiente propicio para que se plieguen de manera adecuada. Sin la ayuda de chaperonas, muchas proteínas no alcanzarían su forma funcional, lo que podría resultar en enfermedades.
¿Cómo se relaciona la estructura de las proteínas con las enfermedades?
La estructura de las proteínas está íntimamente relacionada con su función, y cualquier alteración en su conformación puede llevar a enfermedades. Por ejemplo, las mutaciones en la secuencia de aminoácidos pueden causar que las proteínas se plieguen incorrectamente, lo que puede dar lugar a condiciones como la fibrosis quística o la enfermedad de Alzheimer. Comprender estas relaciones es crucial para el desarrollo de tratamientos efectivos.