Las proteínas son moléculas esenciales para la vida, desempeñando roles cruciales en casi todos los procesos biológicos. Pero, ¿qué hace que estas macromoléculas sean tan versátiles y funcionales? La respuesta se encuentra en los enlaces característicos que las unen y determinan su estructura y función. En este artículo, exploraremos a fondo el enlace característico de las proteínas, su importancia en la biología celular y los diferentes tipos que existen. Desde los enlaces peptídicos que forman la columna vertebral de las proteínas hasta las interacciones más complejas que permiten su plegamiento y función, desglosaremos cada aspecto para ofrecerte una visión clara y completa. Acompáñanos en este recorrido por el fascinante mundo de las proteínas y descubre cómo estos enlaces son fundamentales para la vida tal como la conocemos.
¿Qué son las Proteínas y por qué son Importantes?
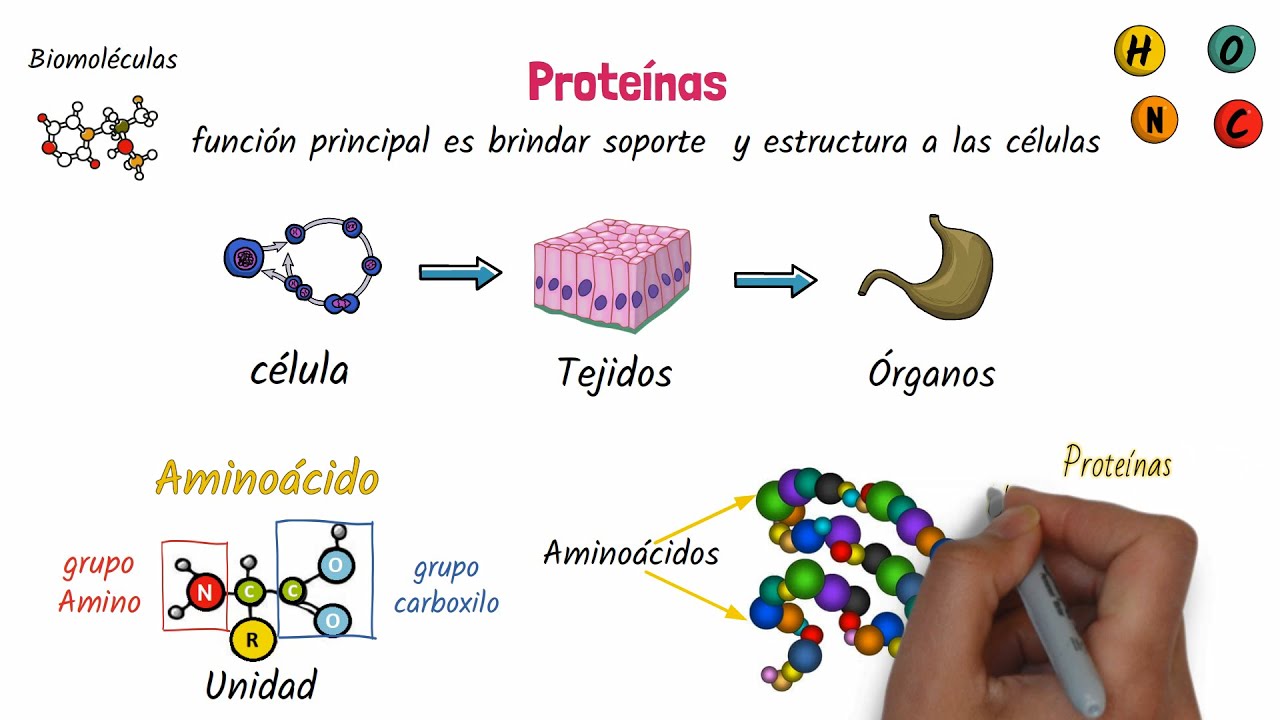
Las proteínas son macromoléculas compuestas por cadenas de aminoácidos. Estas moléculas son fundamentales para la estructura, función y regulación de los tejidos y órganos del cuerpo. La variedad de funciones que desempeñan las proteínas incluye:
- Catálisis: Las enzimas, que son proteínas, aceleran reacciones químicas esenciales para la vida.
- Estructura: Muchas proteínas forman la base estructural de células y tejidos, como el colágeno en la piel.
- Transporte: Algunas proteínas transportan moléculas en el cuerpo, como la hemoglobina que transporta oxígeno en la sangre.
- Regulación: Las proteínas también actúan como hormonas y factores de señalización que regulan procesos biológicos.
Para comprender cómo las proteínas pueden realizar estas diversas funciones, es esencial explorar los enlaces que las componen. La estructura de una proteína se determina por la secuencia de aminoácidos y los enlaces que los unen, lo que a su vez afecta su función biológica.
El Enlace Peptídico: La Base de las Proteínas
El enlace peptídico es el enlace característico más fundamental en las proteínas. Este enlace se forma entre el grupo amino de un aminoácido y el grupo carboxilo de otro, liberando una molécula de agua en un proceso conocido como deshidratación. Este tipo de enlace es responsable de la formación de cadenas polipeptídicas, que son la estructura primaria de las proteínas.
1 Formación del Enlace Peptídico
La formación del enlace peptídico es un proceso que ocurre durante la síntesis de proteínas en los ribosomas. A medida que se añaden aminoácidos a la cadena en crecimiento, el enlace peptídico se establece mediante un mecanismo que involucra el ARN mensajero (ARNm) y el ARN de transferencia (ARNt). Este proceso es crucial para la producción de proteínas funcionales en las células.
2 Propiedades del Enlace Peptídico
Los enlaces peptídicos tienen propiedades únicas que afectan la estructura de las proteínas. Son enlaces covalentes, lo que significa que son bastante fuertes y estables. Sin embargo, también tienen un carácter parcialmente doble, lo que limita la rotación alrededor del enlace y contribuye a la rigidez de la cadena polipeptídica. Esta rigidez es fundamental para el plegamiento correcto de las proteínas.
Enlaces de Hidrógeno: La Fuerza de la Interacción
Una vez que se forma la cadena polipeptídica, las proteínas adoptan estructuras más complejas a través de interacciones no covalentes, siendo los enlaces de hidrógeno uno de los más importantes. Estos enlaces se forman entre átomos de hidrógeno y átomos electronegativos como oxígeno o nitrógeno, y son cruciales para mantener la estructura secundaria de las proteínas, como las hélices alfa y las láminas beta.
1 Estructura Secundaria y Enlaces de Hidrógeno
La estructura secundaria de las proteínas se refiere a las configuraciones locales que pueden formarse debido a los enlaces de hidrógeno. Las hélices alfa, por ejemplo, son estructuras en espiral que se estabilizan mediante estos enlaces. Por otro lado, las láminas beta consisten en cadenas polipeptídicas que se alinean y se estabilizan por enlaces de hidrógeno entre ellas. Estas configuraciones son esenciales para la funcionalidad de la proteína.
2 Ejemplos de Proteínas con Estructura Secundaria
Un ejemplo clásico de una proteína que presenta una estructura secundaria rica en hélices alfa es la queratina, que se encuentra en el cabello y las uñas. Por otro lado, la fibroína, que compone la seda, es rica en láminas beta. La variedad en la estructura secundaria permite a las proteínas adaptarse a diferentes funciones biológicas.
Interacciones Hidrofóbicas: El Plegamiento de las Proteínas
Las interacciones hidrofóbicas son esenciales para el plegamiento tridimensional de las proteínas. Los aminoácidos hidrofóbicos tienden a agruparse en el interior de la proteína, lejos del agua, lo que ayuda a estabilizar la estructura tridimensional final. Este proceso es fundamental, ya que la forma de una proteína está íntimamente relacionada con su función.
1 El Papel del Entorno en el Plegamiento
El entorno celular, que incluye factores como el pH y la concentración de iones, también afecta el plegamiento de las proteínas. Cambios en estas condiciones pueden provocar desnaturalización, un proceso donde la proteína pierde su estructura y, por ende, su función. Esto es evidente en muchas enfermedades, donde las proteínas mal plegadas pueden acumularse y causar daño celular.
2 Ejemplos de Desnaturalización
Un ejemplo conocido de desnaturalización es la desnaturalización de la albúmina de huevo al calentarla, lo que provoca que pase de un estado líquido a un sólido. En enfermedades como el Alzheimer, se ha observado que las proteínas mal plegadas pueden formar agregados tóxicos que afectan las células neuronales.
Enlaces Iónicos y Fuerzas de Van der Waals: Otras Interacciones Importantes
Además de los enlaces peptídicos, los enlaces de hidrógeno y las interacciones hidrofóbicas, las proteínas también están estabilizadas por enlaces iónicos y fuerzas de Van der Waals. Los enlaces iónicos se forman entre grupos cargados en los aminoácidos, mientras que las fuerzas de Van der Waals son interacciones más débiles que ocurren entre moléculas cercanas.
1 Enlaces Iónicos en Proteínas
Los enlaces iónicos son particularmente importantes en la estabilización de la estructura terciaria de las proteínas. Por ejemplo, en la hemoglobina, los enlaces iónicos entre los residuos de aminoácidos contribuyen a mantener la estructura necesaria para su función de transporte de oxígeno. La alteración de estos enlaces puede afectar la capacidad de la hemoglobina para unirse al oxígeno.
2 Fuerzas de Van der Waals
Las fuerzas de Van der Waals, aunque son más débiles que los enlaces covalentes y los enlaces iónicos, también juegan un papel crucial en la estabilización de la estructura proteica. Estas interacciones permiten que las proteínas mantengan su forma y, por lo tanto, su funcionalidad. Un ejemplo de esto se puede observar en las proteínas globulares, donde estas fuerzas ayudan a mantener la compactación necesaria para su actividad.
La Relación entre Estructura y Función en las Proteínas
La relación entre la estructura y la función de las proteínas es fundamental en biología. Cada tipo de proteína tiene una estructura única que le permite realizar su función específica. Esta relación se puede observar en diferentes tipos de proteínas, como enzimas, anticuerpos y receptores de membrana.
1 Enzimas: Proteínas Catalizadoras
Las enzimas son proteínas que catalizan reacciones químicas. Su estructura activa, conocida como sitio activo, se adapta específicamente a sus sustratos. La forma del sitio activo es crucial para la función de la enzima, ya que permite que se unan de manera específica y eficiente. Un ejemplo es la enzima lactasa, que descompone la lactosa en glucosa y galactosa.
2 Anticuerpos: Defensores del Organismo
Los anticuerpos son proteínas del sistema inmunológico que reconocen y se unen a antígenos. Su estructura permite una gran variabilidad, lo que les permite adaptarse a diferentes patógenos. Esta variabilidad se logra a través de la recombinación de segmentos de ADN que codifican para diferentes partes de la proteína, lo que resulta en anticuerpos altamente específicos.
Implicaciones de los Enlaces en la Salud y Enfermedades
La comprensión de los enlaces característicos de las proteínas tiene importantes implicaciones en la salud y las enfermedades. Muchas enfermedades están relacionadas con proteínas mal plegadas o defectuosas. Por ejemplo, la fibrosis quística es causada por una mutación en la proteína CFTR, lo que afecta su capacidad para regular el transporte de cloro en las células.
1 Enfermedades Relacionadas con el Plegamiento de Proteínas
Las enfermedades priónicas, como el síndrome de Creutzfeldt-Jakob, son causadas por proteínas mal plegadas que inducen el mal plegamiento de otras proteínas normales. Esto resalta la importancia de los enlaces y la estructura proteica en la salud. La investigación en este campo ha llevado al desarrollo de terapias que buscan corregir o prevenir el mal plegamiento.
2 Terapias Dirigidas y Tratamientos
El conocimiento de los enlaces característicos de las proteínas también ha permitido el desarrollo de tratamientos dirigidos en enfermedades como el cáncer, donde se diseñan fármacos que interactúan específicamente con proteínas mutadas o sobreexpresadas. Estos tratamientos buscan restaurar la función normal de las proteínas afectadas y mejorar la respuesta del organismo a la enfermedad.
¿Qué es un enlace peptídico y por qué es importante?
El enlace peptídico es el enlace covalente que une los aminoácidos en una cadena polipeptídica. Este enlace es fundamental porque forma la estructura primaria de las proteínas, determinando su secuencia y, por ende, su función. Sin enlaces peptídicos, no existirían las proteínas tal como las conocemos.
¿Cómo afectan los enlaces de hidrógeno a la estructura de las proteínas?
Los enlaces de hidrógeno son cruciales para mantener la estructura secundaria de las proteínas, como las hélices alfa y las láminas beta. Estas interacciones no covalentes permiten que las proteínas adopten formas específicas que son esenciales para su función biológica. Sin estos enlaces, las proteínas no podrían mantener su conformación adecuada.
¿Qué papel juegan las interacciones hidrofóbicas en el plegamiento de proteínas?
Las interacciones hidrofóbicas ayudan a que los aminoácidos hidrofóbicos se agrupen en el interior de la proteína, alejándose del agua. Este proceso es esencial para el plegamiento tridimensional de la proteína, que es crucial para su funcionalidad. Sin estas interacciones, las proteínas no podrían adoptar su forma activa.
¿Qué es la desnaturalización de proteínas y cómo ocurre?
La desnaturalización es el proceso por el cual una proteína pierde su estructura tridimensional y, por lo tanto, su función. Esto puede ocurrir debido a cambios en el pH, temperatura o concentración de iones. Cuando una proteína se desnaturaliza, sus enlaces y estructuras se rompen, lo que puede llevar a la pérdida de su actividad biológica.
¿Cómo se relaciona la estructura de una proteína con su función?
La estructura de una proteína está íntimamente relacionada con su función. Cada tipo de proteína tiene una forma única que le permite interactuar con otras moléculas de manera específica. Por ejemplo, las enzimas tienen sitios activos que se adaptan a sus sustratos, lo que les permite catalizar reacciones químicas de manera eficiente.
¿Qué enfermedades están relacionadas con el mal plegamiento de proteínas?
El mal plegamiento de proteínas está relacionado con varias enfermedades, incluyendo enfermedades neurodegenerativas como el Alzheimer y enfermedades priónicas. En estos casos, las proteínas mal plegadas pueden formar agregados tóxicos que afectan la función celular y causan daño en los tejidos.
¿Cómo se están utilizando los conocimientos sobre proteínas en tratamientos médicos?
Los conocimientos sobre la estructura y función de las proteínas están siendo utilizados para desarrollar tratamientos dirigidos en enfermedades como el cáncer. Los investigadores están diseñando fármacos que pueden interactuar específicamente con proteínas mutadas, buscando restaurar su función normal y mejorar la respuesta del organismo a