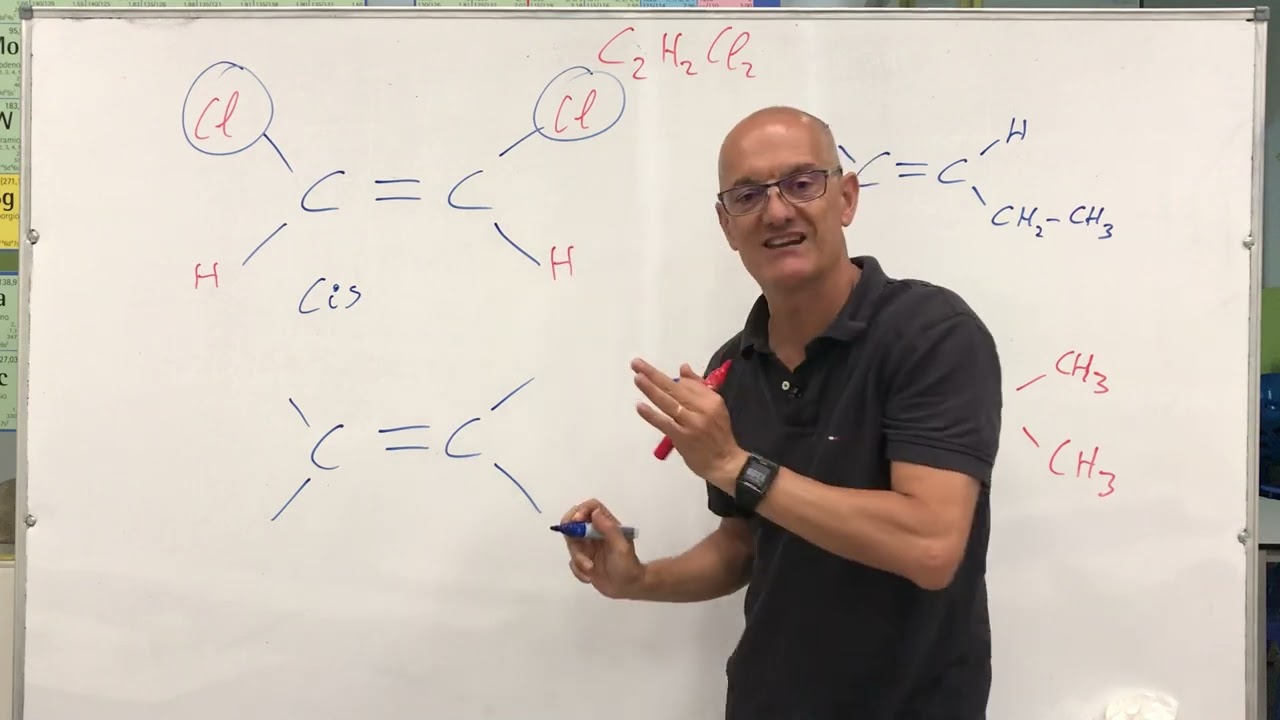La isomería cis-trans es un concepto fundamental en la química orgánica que se refiere a la disposición espacial de los átomos en una molécula. Este fenómeno es crucial para entender cómo las estructuras moleculares afectan las propiedades físicas y químicas de los compuestos. Si alguna vez te has preguntado por qué ciertos compuestos tienen características tan diferentes a pesar de tener la misma fórmula molecular, la respuesta radica en la isomería. En este artículo, vamos a explorar en detalle los ejercicios resueltos de isomería cis-trans, proporcionándote ejemplos prácticos que te ayudarán a comprender mejor este fascinante tema. A lo largo del texto, abordaremos definiciones, características, ejemplos y resolveremos ejercicios para que puedas aplicar lo aprendido de manera efectiva.
¿Qué es la Isomería Cis-Trans?
La isomería cis-trans, también conocida como isomería geométrica, se presenta en compuestos que tienen restricciones en su rotación alrededor de un doble enlace o en estructuras cíclicas. Esto significa que, a pesar de tener la misma fórmula molecular, los átomos pueden estar dispuestos de diferentes maneras en el espacio, lo que resulta en isómeros que pueden tener propiedades físicas y químicas distintas.
Definición de Isómeros Cis y Trans
Los isómeros cis son aquellos en los que los grupos funcionales o sustituyentes están ubicados en el mismo lado de un doble enlace o de una estructura cíclica. Por otro lado, los isómeros trans tienen estos grupos en lados opuestos. Esta diferencia en la disposición espacial puede influir en características como el punto de ebullición, la solubilidad y la reactividad química.
Ejemplos Comunes de Isomería Cis-Trans
Un ejemplo clásico de isomería cis-trans es el buteno, un hidrocarburo con la fórmula C4H8. En el buteno cis, los grupos metilo (CH3) están en el mismo lado del doble enlace, mientras que en el buteno trans, estos grupos están en lados opuestos. Esta diferencia estructural resulta en diferentes propiedades físicas, como el punto de ebullición: el buteno cis tiene un punto de ebullición más alto debido a su forma que genera mayor polaridad.
Características de la Isomería Cis-Trans
Entender las características de la isomería cis-trans es esencial para aplicar este conocimiento en ejercicios prácticos. A continuación, exploramos algunas de las propiedades más relevantes de estos isómeros.
Propiedades Físicas
Las propiedades físicas de los isómeros cis y trans pueden diferir notablemente. Por ejemplo, los isómeros cis tienden a ser más polares que sus contrapartes trans, lo que puede resultar en puntos de ebullición y de fusión más altos. Esta polaridad también puede influir en su solubilidad en diferentes disolventes.
- Punto de ebullición: Generalmente, los isómeros cis tienen puntos de ebullición más altos debido a su mayor polaridad.
- Solubilidad: Los isómeros cis suelen ser más solubles en solventes polares que los trans.
- Reactividad química: La disposición espacial de los grupos funcionales puede afectar la reactividad en ciertas reacciones químicas.
Propiedades Químicas
Además de las propiedades físicas, las características químicas de los isómeros cis y trans pueden ser diferentes. Por ejemplo, en reacciones de adición, los isómeros cis pueden reaccionar de manera diferente a los trans debido a la orientación de los grupos funcionales. Esto puede influir en la formación de productos y en la velocidad de reacción.
Ejercicios Resueltos de Isomería Cis-Trans
Ahora que hemos establecido una base teórica, es momento de aplicar este conocimiento a través de ejercicios resueltos. A continuación, te presentamos algunos ejemplos prácticos que ilustran cómo identificar y resolver problemas relacionados con la isomería cis-trans.
Ejercicio 1: Identificación de Isómeros
Considera el compuesto 2-buteno. ¿Cuántos isómeros cis y trans puedes identificar? Para resolverlo, primero dibuja la estructura del 2-buteno. Recuerda que el 2-buteno tiene un doble enlace entre el segundo y tercer carbono, lo que permite la existencia de isómeros cis y trans.
- Isómero cis: Los grupos metilo están en el mismo lado del doble enlace.
- Isómero trans: Los grupos metilo están en lados opuestos del doble enlace.
Por lo tanto, el 2-buteno tiene dos isómeros: cis-2-buteno y trans-2-buteno.
Ejercicio 2: Comparación de Propiedades
Ahora, comparemos las propiedades del cis-2-buteno y el trans-2-buteno. Considera sus puntos de ebullición. ¿Cuál crees que tiene un punto de ebullición más alto? Utiliza la información sobre polaridad y estructura para justificar tu respuesta.
El cis-2-buteno, al ser más polar, tendrá un punto de ebullición más alto que el trans-2-buteno. Esta diferencia se debe a que las fuerzas intermoleculares son más fuertes en el isómero cis, lo que requiere más energía para separarlas durante la ebullición.
Aplicaciones de la Isomería Cis-Trans en la Vida Cotidiana
La isomería cis-trans no es solo un concepto teórico; tiene aplicaciones prácticas en diversas áreas, desde la química orgánica hasta la biología y la farmacología. Comprender cómo funciona la isomería puede ser esencial para el desarrollo de nuevos medicamentos, la producción de materiales y la investigación científica.
Uso en Medicamentos
Muchos medicamentos tienen isómeros cis y trans, y la diferencia entre ellos puede afectar su eficacia y seguridad. Por ejemplo, algunos fármacos pueden ser más efectivos en su forma cis, mientras que otros pueden tener efectos secundarios en su forma trans. Esta variabilidad resalta la importancia de estudiar y comprender la isomería al desarrollar nuevos tratamientos.
Impacto en la Química de Materiales
En la industria de los materiales, la isomería cis-trans puede influir en las propiedades físicas de polímeros y plásticos. Por ejemplo, el caucho natural tiene isómeros cis y trans que afectan su elasticidad y durabilidad. Al manipular estos isómeros, los científicos pueden crear materiales con propiedades específicas para diversas aplicaciones.
¿Qué es la isomería cis-trans?
La isomería cis-trans es un tipo de isomería que se presenta en compuestos con dobles enlaces o en estructuras cíclicas, donde los grupos funcionales pueden estar ubicados en el mismo lado (cis) o en lados opuestos (trans). Esta disposición espacial afecta las propiedades físicas y químicas de los compuestos.
¿Cuáles son las diferencias entre los isómeros cis y trans?
Los isómeros cis tienen grupos funcionales en el mismo lado del doble enlace, lo que les confiere mayor polaridad y, generalmente, puntos de ebullición más altos. En contraste, los isómeros trans tienen los grupos en lados opuestos, lo que suele resultar en menor polaridad y puntos de ebullición más bajos.
¿Cómo se identifican los isómeros cis y trans en una molécula?
Para identificar isómeros cis y trans, es necesario observar la disposición de los grupos funcionales en relación con el doble enlace o la estructura cíclica. Dibujar la estructura de la molécula puede facilitar esta identificación. Si los grupos están en el mismo lado, se trata de un isómero cis; si están en lados opuestos, es un isómero trans.
¿Por qué es importante la isomería en la química orgánica?
La isomería es crucial en la química orgánica porque los isómeros pueden tener propiedades físicas y químicas diferentes, lo que afecta su comportamiento en reacciones y su aplicación en la industria, la farmacología y otros campos. Comprender la isomería permite a los científicos diseñar compuestos con características específicas.
¿Qué ejemplos de compuestos presentan isomería cis-trans?
Un ejemplo clásico es el buteno, que puede existir como cis-2-buteno y trans-2-buteno. Otros ejemplos incluyen el ácido 2-butenoico y el ciclohexeno. Estos compuestos muestran cómo la disposición de grupos funcionales puede influir en sus propiedades y reactividad.
¿La isomería cis-trans afecta la solubilidad de los compuestos?
Sí, la isomería cis-trans puede influir en la solubilidad de los compuestos. Los isómeros cis suelen ser más polares y, por lo tanto, más solubles en solventes polares, mientras que los isómeros trans tienden a ser menos polares y más solubles en solventes apolares.
¿Qué papel juega la isomería en el diseño de medicamentos?
La isomería es fundamental en el diseño de medicamentos porque diferentes isómeros pueden tener efectos terapéuticos distintos. Algunos isómeros pueden ser más efectivos o tener menos efectos secundarios que otros, lo que hace necesario estudiar y seleccionar el isómero adecuado durante el desarrollo de fármacos.